微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 一个课外兴趣小组对某只含Cu、Fe的合金成分含量进行分析(装置见图)。
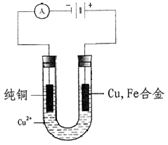
方法:按图示取a g的Cu、Fe合金和纯铜做为电极,电解液里是含足量的Cu2+离子。接通电源进行实验,一直通电到Cu、Fe合金刚好全部溶解时为止。实验结果是:发现在通电实验过程中两电极均无气体产生,纯铜电极上质量增加19.2g,电解液的质量减少0.8g。请回答:
(1)写出电极反应:阳极???????????????????????????????????????????;
阴极????????????????????????????????????????????。
(1)该合金中Cu和Fe的物质的量之比是_________________________。
(3)若另取该合金a g把该Cu、Fe合金与足量的稀硝酸反应后,在溶液中再加入NaOH,能得到的最大沉淀量是________ _g。
参考答案:(10分) (1)Fe-2e-=Fe2+、Cu-2e-=Cu
本题解析:
试题分析:(1)根据装置图可知,Cu、Fe合金和电源的正极相连,做阳极,失去电子,电极反应式是Fe-2e-=Fe2+、Cu-2e-=Cu2+;纯铜和电源的负极相连,做阴极,溶液中的铜离子得到电子,电极反应式是Cu2++2e-=Cu。
(2)设合金中Cu和Fe的物质的量分别是x和y,则19.2-64x-56y=0.8、2x+2y=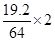 本题难度:一般
本题难度:一般
2、填空题 (14分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)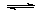 2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g)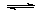 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K= 。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)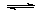 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
1.3×104kPa左右,选择此压强的理由是: 。
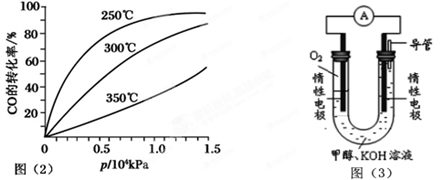
(3)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
①该电池工作时,OH-向 极移动(填“正”或“负”)。
②该电池正极的电极反应式为 。
参考答案:(1)-41.8 BD&
本题解析:
试题分析:(1)根据盖斯定律,②-①即得出2NO2(g)+2SO2(g) 2SO3(g)+2NO(g) ΔH=ΔH2-ΔH1="-113.0" kJ·mol-1+196.6 kJ·mol-1=+83.6kJ·mol-1,所以答案是41.8 kJ·mol-1;反应NO2(g)+SO2(g)
2SO3(g)+2NO(g) ΔH=ΔH2-ΔH1="-113.0" kJ·mol-1+196.6 kJ·mol-1=+83.6kJ·mol-1,所以答案是41.8 kJ·mol-1;反应NO2(g)+SO2(g) SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,对于体积不变的反应压强不能说明达到平衡状态,A错误,颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此B正确;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,C错误;SO3和NO2一个作为生成物,一个作为反应物,因此每消耗1 mol SO3的同时生成1 molNO,可以说明该反应达到平衡状态;设加入的二氧化硫物质的量为a,则二氧化氮的为2a,
SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,对于体积不变的反应压强不能说明达到平衡状态,A错误,颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此B正确;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,C错误;SO3和NO2一个作为生成物,一个作为反应物,因此每消耗1 mol SO3的同时生成1 molNO,可以说明该反应达到平衡状态;设加入的二氧化硫物质的量为a,则二氧化氮的为2a,
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的量 2a a 0 0
转化物质的量 x x x x
平衡物质的量 2a-x a-x x x
则(2a-x):(a-x)=5:1,x=3a/4,则平衡时,C( NO2)=5a/4Vmol/L,C(SO2)=a/4Vmol/L
C(SO3)=C(NO)=3a/4V,平衡常数K="(3a/4×3a/4)/(" 5a/4V×a/4V)=1.8。
(2)由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择250℃、1.3×104kPa左右的条件.因为在250℃、压强为1.3×104kPa时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强。
(3)依据甲醇燃烧的反应原理,结合如图所示的原电池装置,负极上失电子发生氧化反应,正极上得到电子发生还原反应;一般燃料在负极上发生反应,氧气在正极发生还原反应;负极电极反应为:CH3OH+8OH--6e-=CO32-+6H2O;阴离子移向负极;正极电极反应为:O2+2H2O+4e-=4OH-;故答案为:负;O2+2H2O+4e-=4OH-。
考点:考查盖斯定律、化学平衡应用、原电池。
本题难度:困难
3、选择题 pH=a某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH<a,则该电解质可能是
A.Ba(OH)2
B.H?Cl
C.Na2SO4
D.AgNO3
参考答案:D
本题解析:
试题分析:A、电解氢氧化钡溶液时,实际上电解的是水,但溶液中的氢氧根离子的浓度增大,氢离子的浓度减小,所以溶液的PH值增大,故A错误;B、电解盐酸溶液时,阴极溶液中氢离子放电,氢离子的浓度减小,pH值增大,故B错误;C、电解硫酸钠溶液时,实际上电解的是水,所以溶液中氢离子和氢氧根离子的相对浓度不变,只是硫酸钠的浓度增大,故pH值不变,故C错误;D、电解硝酸银溶液时,阴极上析出银,阳极上得到氧气,所以溶液中的氢氧根离子的浓度减小,氢离子的浓度增大,溶液的pH值减小,故D正确;故选D.
本题难度:一般
4、填空题 某温度下将一定量密度为1.15g/cm3的NaCl溶液用石墨电极直流电,设NaCl恰好完全反应,且无其它反应发生,得到的溶液中氧元素的质量分数为80%。
(1)求电解后溶液中溶质与溶剂的物质的量之比;
(2)求原NaCl溶液的物质的量浓度。
参考答案:1)1:10
(2)4.5mol/L
设:NaO
本题解析:略
本题难度:简单
5、选择题 如下图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,下列叙述中正确的是
 [???? ]
[???? ]
A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式4OH--4e-=2H2O+O2↑
C.乙烧杯中滴入酚酞试液,D极附近先变红
D.烧杯中C极上电极反应式为4H++4e-=2H2↑
参考答案:C
本题解析:
本题难度:一般