微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验

将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S??? 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
① 阳极区硫酸铁的主要作用是???????。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是???????。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式???????。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是???????;加入有机萃取剂的目的是???????。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是???????。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是???????。
参考答案:(16分)
(1)①吸收硫化氢气体,防止环境污染(1分
本题解析:
试题分析:
(1)根据反应:CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S??? 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+①可知硫酸铁作用为吸收硫化氢气体,防止环境污染;②吸收硫化氢气体要消耗Fe3+ ,而其浓度不变必须Fe2+在阳极放电:Fe2+- e-→Fe3+。
(2)根据题中现象和离子放电规律可知:2H++2 e-→H2↑?
Cu2++2e-→Cu???? 2Cu+O2+2H2SO4=2CuSO4+2H2O(各1分)
(3)分离
本题难度:困难
2、选择题 用惰性电极电解2L1.0mol·L-1CuSO4溶液,在电路中通过0.5mol电子后,调换正负极继续电解,电路中又通过了1mo1电子,此时溶液中c(H+)(假设溶液体积不变)为(??)
A.1.5mol·L-1
B.0.75mol·L-1
C.0.5mol·L-1
D.0.25mol·L-1
参考答案:C
本题解析:调换正负极前后电极反应式如下:
调换前:阳极:4OH-―4e- 2H2O+O2↑阴极:2Cu2++4e-
2H2O+O2↑阴极:2Cu2++4e- 2Cu
2Cu
本题难度:一般
3、选择题 以惰性电极进得电解下列溶液液,阳阴极产物的物质的量相等的是( )
A.盐酸
B.硫酸
C.碳酸钠
D.氯化铜
参考答案:A、电解盐酸溶液时,阴极上氢离子得电子生成氢气,阳极上氯离子
本题解析:
本题难度:简单
4、选择题 用铂电极电解100mL HNO3与 AgNO3的混合液,通电一段时间后,两极均收集到2.24 L 气体(标准状况),则原混合液中Ag+的物质的量浓度为 (????????????? )
A.1mol/L
B.2mol/L
C.2.5mol/L
D.3mol/L
参考答案:B
本题解析:
试题分析:在阳极上生成0.1molO2时,转移电子的物质的量为0.4mol,当阴极上生成0.1molH2时转移电子的物质的量为0.2mol,故银离子需得0.2mol电子,银离子的物质的量为0.2mol,浓度为2mol/L。
本题难度:一般
5、选择题 表示下列变化的化学用语正确的是
A.Na2CO3的水解:CO32-+H2O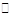 H2CO3+2OH-
H2CO3+2OH-
B.用石墨电极电解硫酸铜溶液:2Cu2++4OH- 2Cu+O2↑+2H2O
2Cu+O2↑+2H2O
C.钢铁发生吸氧腐蚀的正极反应式为:O2 +2H2O+4e- = 4OH-
D.草酸使酸性高锰酸钾溶液褪色:2MnO4—+5C2O42—+16H+=2Mn2++10CO2↑+8H2O
参考答案:C
本题解析:
试题分析:CO32-是弱酸阴离子,分步水解,A项错误;用石墨(惰性电极)电解硫酸铜溶液,阳极是水电离出的OH-放电,所以离子方程式为2Cu2++2H2O 2Cu+O2↑+4H+,B项错误;钢铁发生吸氧腐蚀的正极反应式为:O2 +2H2O+4e- = 4OH-,C项正确;草酸是弱酸,写化学式,D项错误;选C。
2Cu+O2↑+4H+,B项错误;钢铁发生吸氧腐蚀的正极反应式为:O2 +2H2O+4e- = 4OH-,C项正确;草酸是弱酸,写化学式,D项错误;选C。
考点:考查化学用语的正误判断。
本题难度:一般