微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
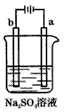
1、选择题 下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是
 [???? ]
[???? ]
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.若电解饱和Na2SO4溶液,一段时间后,溶液中会析出Na2SO4·10H2O晶体
参考答案:D
本题解析:
本题难度:一般
2、填空题 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为__________________________________。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中
a为电解液,X和Y均为惰性电极,则
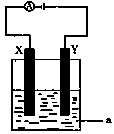
①若a为CuSO4溶液,则电解时的化学反应方程式为 ______________________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的pH=___________(假设电解后溶液体积不变)。
参考答案:(1)B
(2)O2+ 4e-+2H2O=4OH-<
本题解析:
本题难度:一般
3、选择题 下列说法正确的是
A.金属甲的阳离子比同价态的金属乙的阳离子氧化性强,则金属甲比金属乙活泼
B.原电池中电子从负极经过溶液流向正极
C.电解池中电解质溶液的阳离子向阴极迁移
D.在铁制品上镀银,铁做正极,银做负极
参考答案:C
本题解析:
试题分析:A、金属甲的阳离子比同价态的金属乙的阳离子氧化性强,则金属乙比金属甲活泼,A错误;B、原电池中电子从负极经过外电路流向正极,B错误;C、电解池中电解质溶液的阳离子向阴极迁移,C正确;D、在铁制品上镀银,铁做负极,银做正极,D错误;答案选C。
考点:原电池、电解池、电镀
本题难度:一般
4、选择题 如图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑点向d端扩散。下列判断正确的是( )

A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.Z中溶液的pH先减小,后增大
D.溶液中的SO42—向Cu电极定向移动
参考答案:A
本题解析:紫红色斑点即MnO4—向d端扩散,根据阴离子向阳极移动的原理,可知d端为阳极,即b为正极,a为负极。c为阴极,NaCl溶液中H+放电,OH-浓度相对增大,c点附近会变红色。Pt为阳极,溶液中的OH-放电:4OH--4e-=O2↑+2H2O,Cu为阴极,溶液中的Cu2+得电子,生成铜,总反应为2CuSO4+2H2O
本题难度:一般
5、实验题 碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH=5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I―转化为IO3―,装置如图。

(1)在反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为????????。
(2)电解前,将KI和KIO3混合溶液加入阳极区;将氢氧化钾溶液加入阴极区。电解槽用水冷却。电解时,阳极上的电极反应??????????????????????;阴极上得到的气体产物为?????????????????;
(3)某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子反应方程式为?????????????????,为确定电解是否完成,需检验阳极区电解液中是否含有I―,该同学选用淀粉溶液和稀硫酸进行实验,其它仪器及用品自选,请完成其方案:
实验操作
| 现象及结论
|
?
| ?
?
(4)电解完毕,从电解液中得到KIO3晶体的过程为:

步骤①的操作名称????????,步骤④中洗涤晶体的目的?????????????????????????。
参考答案:
(1)5:1
(2)I-+6OH--6e-=I
本题解析:
试题分析:(1)碘元素由0价升为+5价,则I2是还原剂,KIO3是氧化产物,碘元素还由0价降为—1价,则I2还是氧化剂,KI是还原产物;根据系数之比等于物质的量之比,由于氧化产物KIO3为1mol,则还原剂I2为1/2mol,还原产物KI为5mol,则氧化剂I2为5/2mol,所以该反应中氧化剂和还原剂的物质的量之比为5/2∶1/2=5∶1;(2)阳极发生氧化反应,根据题意可知其主要反应物和产物是I―→IO3―;碘元素由—1价升为+5价,根据化合价升高总数等于失去电子数可知,I―—6e―→IO3―
本题难度:困难
|