微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:
 3A(g)+B(g)????? 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。
3A(g)+B(g)????? 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。
⑴B的平衡浓度为??????????。
⑵A的转化率为???????????。
⑶用D表示的平均反应速率为???????。
⑷如果缩小容器容积(温度不变),则平衡体系中混合气体的密度???????、平均相对分子质量?????????。(两空均填“增大、“减少”或“不变”)
参考答案:(10分)⑴0.8mol·L-1(2分);⑵ 60%(2分)
本题解析:略
本题难度:简单
2、选择题 对于反应A2(g)+2B(g)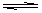 2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是
2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是
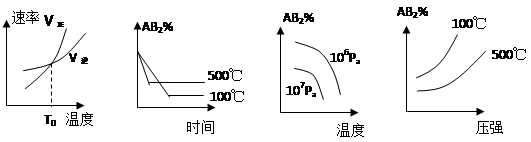
A.???????????????? B.??????????????? C.??????????????? D.
参考答案:D
本题解析:
A、不正确,由图可知,升高温度,平衡正向移动,与放热反应不相符;
B、不正确,由图可知,升高温度,AB2含量增加,平衡正向移动,与放热反应不相符;
C、不正确,由图可知,增大压强,AB2含量减小,与反应增大压强,平衡正向移动不相符。
D、正确,升高温度,平衡逆向移动,增大压强,平衡正向移动。
本题难度:一般
3、填空题 利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表

已知1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式
_________________________。
(2)500℃、50MPa时,在容积为VL的容器中加入1mol N2、3mol H2,此时N2的转化率为a。则平衡时
NH3的浓度为______________。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下
CH2=CH2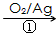
 HOCH2CH2CHO
HOCH2CH2CHO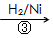 HOCH2CH2CH2OH
HOCH2CH2CH2OH
某化工厂已购得乙烯11.2t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得

假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭___________吨、甲烷_________吨,才能满足生产需要。
参考答案:(1)CH4(g)+H2O(g)==CO(g)+3H2(g)
本题解析:
本题难度:一般
4、选择题 一定条件下,在一固定容积密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
(1)达到平衡时H2的转化率;
(2)平衡时NH3在混合气体中的体积分数。
参考答案:60%; 本题解析:
本题解析:
试题分析:(1)N2 (g)+3H2(g)  2NH3 (g)
2NH3 (g)
起始量(mol)?? 0?????? 0????????? 2a
转化量(mol)??? x????? 3x???????? 2x
平衡量(mol)??? x????? 3x??????? (2a-2x)
所以根据题意可知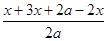 =1.4
=1.4
解得x=0.4a
若开始时充入a mol N2和3a mol H2的混合气体,达到平衡时,与开始充入2a mol NH3平衡等效
所以反应的H2的物质的量为:3a-3x=3a-3×0.4a=1.8a mol
所以H2的转化率为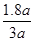 ×100% =60%
×100% =60%
(2)NH3在混合气体中的体积分数: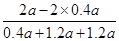 =
=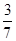 (或42.9%)
(或42.9%)
本题难度:一般
5、选择题 在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)  3C(g)? ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是(??? )
3C(g)? ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是(??? )
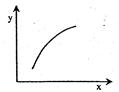
选项
| x
| y
|
A
| 降温
| A的体积分数
|
B
| 升高温度
| 混合气体的密度
|
C
| 再加入A
| B的转化率
|
D
| 再加入C
| A的体积分数
?
参考答案:C
本题解析:
试题分析:A、该反应为放热反应,降温平衡向右移动,A的体积分数减小,错误;B、根据质量守恒定律,气体总质量不变,容器的体积固定,所以混合气体的密度为定值,错误;C、再加入A,B的转化率增大,正确;D、再加入C,因为反应前后气体的系数相等,所以A的体积分数不变,错误。
本题难度:一般
|