3.0
通过计算求出该反应的平衡常数(写出计算过程,结果保留两位有效数字)。
(4)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g)??ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。 2NH3(g)??ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。

请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为??????????????????????????????,判断依据是????????????????????????????????????????????????????????????????。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在下图中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
参考答案:(共13分) (1)2Cl-+2H2O 本题解析: 本题解析:
试题分析:(1)惰性电极电解饱和食盐水的生成物是氯气、氢气和氢氧化钠,所以该反应的离子方程式是2Cl-+2H2O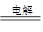 2OH-+H2↑+Cl2↑。 2OH-+H2↑+Cl2↑。
(2)正反应是吸热反应,升高温度,平衡向正反应方向移动,水蒸气的转化率增大,A正确;碳固体,增加固体碳的质量,平衡不移动;催化剂能同等程度改变正逆反应速率,但平衡不移动,B和C不正确;D中降低生成物的浓度,平衡向正反应方向移动,水蒸气的转化率增大,D正确,答案选AD。
(3)??????????CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g)
起始量(mol)??? 2???? 1????????? 0????? 0
转化量(mol)?? 0.4?? 0.4???????? 0.4??? 0.4
平衡量(mol)?? 1.6?? 0.6???????? 0.4??? 0.4
所以该反应的平衡常数K=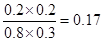
(4)①实验Ⅱ与实验Ⅰ平衡状态相同,而实验Ⅱ达到平衡所需时间短,所以实验Ⅱ使用的条件只能是催化剂。
②由于正反应是放热反应,所以升高温度反应速率增大,到达平衡的时间减少,但氮气的浓度降低,所以正确的图像是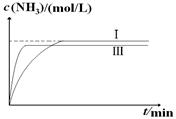 。 。
点评:固体是高考中的常见题型,属于中等难度的试题。试题基础性强,主要是侧重对学生能力的考查。该题有利于培养学生的规范答题能力,也有利于培养学生严谨的逻辑思维能力,有利于调动学生的学习兴趣,激发学生的求知欲,提高学生的学习效率。
本题难度:一般
2、选择题 在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g)+bB(g) cC(g)+dD(g),达到 cC(g)+dD(g),达到
平衡时测得B气体的浓度为0.6 mol/L,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B
气体的浓度为0.4 mol/L,下列叙述中正确的是??????????????????????(???)
A.a+b〈 c+d
B.平衡向右移动
C.重新达平衡时,A气体转化率增大
D.重新达平衡时,D的体积分数减小
参考答案:D
本题解析:略
本题难度:简单
3、选择题 一定温度下,反应H2(g) + X2(g)  2 HX(g)的平衡常数为64,将2 mol H2和2 mol X2通入体积为1L的密闭容器中,该温度下H2的平衡转化率为 2 HX(g)的平衡常数为64,将2 mol H2和2 mol X2通入体积为1L的密闭容器中,该温度下H2的平衡转化率为
A.20﹪
B.40﹪
C. 60﹪
D.80﹪
参考答案:D
本题解析:
试题分析:????????? H2(g) + X2(g)  2 HX(g) 2 HX(g)
起始浓度(mol/L)?? 2????? 2????????????? 0
转换浓度(mol/L)?? x????? x????????????? 2x
平衡浓度(mol/L) 2-x?? 2-x???????????? 2x
则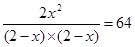
解得x=1.6
所以氢气的转化率是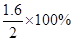 =80%,答案选D。 =80%,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,侧重考查学生灵活运用平衡常数解决实际问题的能力。该类试题需要注意的是在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。
本题难度:一般
4、填空题 一定温度下2 L的恒容容器甲中,加入2 mol碳和2 mol CO2发生如下反应: C(s)+CO2(g)  2CO(g) ΔH>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。 2CO(g) ΔH>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。
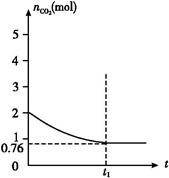
(1)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。?
(2)列式并计算上述温度下此反应的平衡常数 (结果保留一位小数)。?
(3)向上述平衡体系中再通入CO2,则CO2的转化率 (填“增大”、“减小”、“不变”或“无法确定”)。?
(4)相同温度下,2 L的恒容容器乙中加入4 mol碳和4 mol CO2,达到平衡。请在图中画出乙容器中CO2的物质的量随时间t变化关系的预期结果示意图。(注明平衡时CO2的物质的量)
(5)相同温度下,2 L的恒容容器丙中加入4 mol碳、4 mol CO2和4 mol CO。开始反应时v正 v逆(填“>”、“<”或“=”)。?
参考答案:(1)> 较高
(2)K=c2(CO)/c(C
本题解析:(1)根据方程式可知,该反应是熵值增加的,由于反应是吸热反应,根据ΔG=ΔH-TΔS,要使该反应自发进行,ΔG<0,则需要在高温下。
(2)平衡时CO2的物质的量是0.76 mol,则消耗CO2是(2-0.76) mol="1.24" mol,所以生成CO是2.48 mol,因此CO2和CO的浓度分别是0.38 mol/L和1.24 mol/L,所以K=c2(CO)/c(CO2)=1.242/0.38≈4.0。
(3)增大CO2的浓度,则平衡向正反应方向移动,但CO2的转化率降低。
(4)由于CO2的浓度增大,所以反应速率加快,达到平衡的时间减少。设消耗CO2 x mol,则生成CO为2x mol,所以有K=c2(CO)/c(CO2)=x2/(2-0.5x)=4.0,解得x="2" mol,据此可画出示意图。
(5)由于此时c2(CO)/c(CO2)=22/2=2<4.0,所以反应向正反应方向移动,则正反应速率大于逆反应速率。
本题难度:一般
5、填空题 在2L密闭容器中发生3X(g)+Y(g)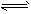 Z(g)+2W(g)反应,现在控制下列三种不同的条件: Z(g)+2W(g)反应,现在控制下列三种不同的条件:
①在400°C时,9mol X 与3molY反应
②在400°C时,15mol X 与5molY反应
③在300°C 时,9mol X 与3molY反应
那么:
(1)反应开始时,正反应速率最大的是(填序号,下同)________,正反应速率最小的是________;
(2)在①条件下的反应进行到第10min时,测得Z为1mol,此时v(Z)=_______mol/(L·min);v(X)=______mol/(L·min)
参考答案:(1)②;③
(2)0.05;0.15
本题解析:
本题难度:一般
|