微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.Na2O2、Na2O均能吸收CO2并放出氧气
B.常温常压干燥的Cl2与铁不反应
C.SO2和Cl2的漂白原理相同
D.Mg、Al、Fe均能在冷的浓硝酸中钝化
参考答案:B
本题解析:分析:A.Na2O2与CO2反应:2Na2O2+2CO2═2Na2CO3+O2,Na2O与CO2反应:Na2O+CO2═Na2CO3;
B.常温常压干燥的Cl2与铁不反应,在点燃条件下能反应;
C.SO2、Cl2的漂白原理分别是化合漂白、氧化漂白;
D.在常温下,金属铁和金属铝遇到浓硝酸、浓硫酸会发生钝化.
解答:A.Na2O2能吸收CO2并放出氧气,而Na2O能吸收CO2不放出氧气,故A错误;
B.常温常压干燥的Cl2与铁不反应,在点燃条件下能反应,故B正确;
C.SO2、Cl2的漂白原理分别是化合漂白、氧化漂白,漂白原理不相同,故C错误;
D.Al、Fe均能在冷的浓硝酸中钝化,而Mg在冷的浓硝酸中不钝化,故D错误;
故选B.
点评:本题主要考查了物质的性质与用途,难度不大,根据所学知识即可完成.
本题难度:一般
2、选择题 据人民网-国际金融报报道:全球最大铁矿石生产商必和必拓的中国总裁克林顿-丹尼斯2005年12月8日在北京表示,由于供应紧张,全球铁矿石价格在未来两年内将继续上涨.则下列有关铁及其化合物的有关说法中正确的是
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加铁粉,然后过滤
D.Fe3+与KSCN产生血红色沉淀
参考答案:C
本题解析:赤铁矿的主要成分是Fe2O3,铁与水蒸气在高温下的反应产物为Fe3O4和H2,铁离子与KSCN溶液变为血红色,但没有沉淀产生,一般可以用此方法检验铁离子的存在.
本题难度:一般
3、选择题 1989年世界卫生组织把铝确定为食品污染源之一,对在食品中的应用加以限制.按照这一要求铝在下列应用中应加以控制的是
①铝合金??
②制电线??
③制炊具??
④用氢氧化铝凝胶制胃舒平药品???
⑤用明矾净化饮用水??
⑥明矾与小苏打制食品膨松剂.
A.①②③
B.②④⑥⑤
C.③⑤⑥
D.③④⑤⑥
参考答案:D
本题解析:分析:铝制炊具在烹制食物时铝可能随食物进入人体,明矾是十二水硫酸铝钾,其中含有铝,在净化水的过程中铝可能随水进入人体,也可能随食品进入人体,铝制易拉罐中的铝可能随饮料进入人体,胃舒平药剂中的铝对人体有危害,包装糖果和小食品的铝也可能进入人体.
解答:①铝合金是工业中应用最广泛的一类有色金属结构材料;
②制电线,铝的导电性较好不需控制;
③④⑤⑥使用铝制品包装食品、制炊具可能对人体有危害,用含有铝的物质净化水或制药物或制食品蓬松剂对人体有危害.
故选D
点评:本题考查了铝性质的应用,本题要掌握铝可能进入人体的途径,例如铝可以通过饮食、药物等途径进入人体从而危害人体健康.
本题难度:简单
4、选择题 将5.6gFe在一定量稀硝酸中恰好完全溶解后,往溶液中滴加NaOH溶液立即产生沉淀,滴加至沉淀量最大时止,再将所得溶液和沉淀一起加热蒸干并在空气中灼烧至恒重,所得固体成分和质量可能为
A.A
B.B
C.C
D.D
参考答案:AB
本题解析:分析:根据5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,5.6gFe的物质的量为0.1mol,加入氢氧化钠后蒸干,得到0.1mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.2mol硝酸钠,或硝酸钠0.3mol,最后得到0.05mol氧化铁和0.2mol硝酸钠或0.3mol亚硝酸钠,可分别计算出亚硝酸钠的质量范围.
解答:如果25.6gFe的物质的量=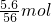 =0.1mol,铁全部恰好生成硝酸亚铁,则硝酸亚铁物质的量为0.1mol,加入氢氧化钠后蒸干,得到0.1mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.2mol硝酸钠,
=0.1mol,铁全部恰好生成硝酸亚铁,则硝酸亚铁物质的量为0.1mol,加入氢氧化钠后蒸干,得到0.1mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.2mol硝酸钠,
根据元素质量守恒可得加热生成0.05mol氧化铁和0.2mol亚硝酸钠,
质量是:氧化铁0.05mol×160g/mol=8g,亚硝酸钠0.2mol×69g/mol=13.8g
如果恰好生成硝酸铁0.1mol,则氧化铁依然是0.05mol,硝酸钠是0.3mol,
灼烧生成氧化铁4g,根据N元素守恒可得亚硝酸钠0.3mol,质量为0.3mol×69g/mol=20.7g
所以氧化铁质量肯定是4g,亚硝酸钠质量应该在[13.8,20.7]区间内,
故选AB.
点评:本题考查混合物的计算,题目难度较大,本题考虑5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,利用端值法求解,注意加热氢氧化亚铁时生成氧化铁而不是氧化亚铁,为易错点.
本题难度:简单
5、选择题 下列金属或氧化物可以完全溶解的是
A.1molZn与含1molHCl的稀溶液共热
B.1molCu与含4molHNO3的浓硝酸
C.1molCu与含2molH2SO4的浓硫酸共热
D.1molMnO2与含4molHCl的浓盐酸共热
参考答案:B
本题解析:
本题难度:困难