微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在实验中,要想使氯化铝溶液中的Al3+。全部沉淀出来,最好选用下列试剂中的
A.石灰水
B.氢氧化钠溶液
C.硫酸
D.氨水
参考答案:D
本题解析:由于氢氧化铝是两性氢氧化物,既能溶于酸中,也能溶于强碱中,所以要沉淀氯化铝中的铝离子,最好选择弱碱氨水,答案选D。
本题难度:一般
2、选择题 事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律.如:Na2O2+SO2═Na2SO4、2Na2O2+2SO3═2Na2SO4+O2,则你认为下列方程式中不正确的是
A.2Na2O2+2Mn2O7═4NaMnO4+O2↑
B.2Na2O2+2N2O3═4NaNO2+O2↑
C.2Na2O2+P2O3=Na4P2O7
D.2Na2O2+2N2O5=4NaNO3+O2↑
参考答案:B
本题解析:分析:题给信息为:Na2O2可与某些元素的最高价氧化物反应,生成对应的盐(或碱)和O2,Na2O2具有强氧化性,与所含元素不是最高价态的氧化物反应时,只生成相对应的盐,不生成O2.
解答:A、七氧化二锰是最高价态的锰的氧化物,NaMnO4中的锰为+7价,符合上述规律,故A正确;
B、三氧化二氮不是最高价态的氮的氧化物,不符合上述规律,故B错误;
C、三氧化二磷不是最高正价,生成Na4P2O7,符合上述规律,故C正确;
D、五氧化二氮是最高价态的氮的氧化物,因此过氧化钠与五氧化二氮反应生成硝酸钠和氧气,故D正确;
故选B.
点评:本题根据题目信息得出规律,主要考查化学方程式的书写,难度较大.
本题难度:困难
3、选择题 同浓度同体积的Na2CO3和NaHCO3溶液中,分别加入等体积等浓度的盐酸,结果是
A.Na2CO3产生的CO2多
B.NaHCO3产生的CO2多
C.NaHCO3的反应速率快
D.二者产生的CO2一样多
参考答案:C
本题解析:
本题难度:一般
4、选择题 将新制氯水分别滴加到下列溶液中至过量,对所观察到的现象描述合理的一组是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:氯气与水发生:Cl2+H2O=HCl+HClO,HClO具有弱酸性、强氧化性、漂白性以及不稳定性,氯水中含有Cl2、HClO和H2O等分子,以此解答该题.
解答:A.氯水呈酸性,并具有氧化性和漂白性,加入到滴有酚酞的NaOH溶液,溶液颜色褪色,故A错误;
B.氯水中含有Cl-离子,滴入到硝酸银溶液中有AgCl沉淀生成,含有HClO,可使品红褪色,含有H+,与碳酸钠反应生成气体,故B错误;
C.氯水中含有Cl-离子,滴入到硝酸银溶液中有AgCl沉淀生成,含有HClO,加入到滴有酚酞的NaOH溶液,溶液颜色褪色,可使品红褪色,含有H+,与碳酸钠反应生成气体,可使石蕊先变红后褪色,故C正确;
D.氯水中含有HClO,加入到滴有酚酞的NaOH溶液,溶液颜色褪色,可使品红褪色,含有H+,与碳酸钠反应生成气体,可使石蕊先变红后褪色,故D错误.
故选C.
点评:本题考查氯水的性质,题目难度中等,解答本题,明确绿水的成分和性质是关键,学习中注重相关基础知识的积累.
本题难度:一般
5、选择题 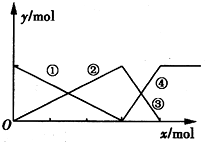 如图表示AlCl3溶液与NaoH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是
如图表示AlCl3溶液与NaoH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是
A.①线表示Al3+的物质的量的变化
B.x表示AlCl3的物质的量
C.③线表示Al(OH)3的物质的量的变化
D.④线表示的物质的量的变化
参考答案:B
本题解析:分析:假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,
假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗 molAl3+,生成
molAl3+,生成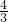 molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
molAl(OH)3↓,前后两部分消耗的Al3+为1mol: mol=3:1,
mol=3:1,
由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答.
解答:假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,
假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗 molAl3+,生成
molAl3+,生成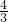 molAl(OH)3↓,前后两部分消耗的A 91ExaM.orgl3+为1mol:
molAl(OH)3↓,前后两部分消耗的A 91ExaM.orgl3+为1mol: mol=3:1,
mol=3:1,
由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,
A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,故A正确;
B.由上述分析可知,X表示NaOH溶液,故B错误;
C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,或减小,故②③线表示Al(OH)3的物质的量的变化,故C正确;
D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,故D正确;
故选B.
点评:本题考查镁铝重要化合物、离子反应、化学计算等,难度较大,根据相互滴加过程离子物质的量的变化确定图象表示向AlCl3溶液中滴加NaOH溶液是解题的关键.
本题难度:简单