D
n(Fe2O3)
0.350
0.027
0.080
0.080
n(CO)
0.010
0.010
0.010
0.050
n(Fe)
0.100
0.064
0.080
0.080
n(CO2)
0.035
0.088
0.040
0.050
参考答案:(1)反应13
本题解析:
本题难度:一般
2、选择题 已知300℃、70MPa下由二氧化碳和氢气合成乙醇的反应成为现实:
2CO2(g)+6H2(g) ?CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是 ?CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是
A.升高温度,该反应的平衡常数将增大
B.再向该容器中充入1molH2和1molCO2,达到平衡时,H2的转化率将高于CO2
C.加入催化剂或从平衡混合气中分离出水蒸气均可提高CO2和H2的利用率
D.T℃,在容积可变的密闭容器中将3molH2和1molCO2混合,达到平衡时乙醇的体积分
数大于a
参考答案:BD
本题解析:
分析:根据催化剂、温度、浓度对化学反应速率和化学平衡的影响来分析解答,注意题中没有明确该反应为吸热还是放热,温度变化不能确定移动方向.
解:A.题中没有明确该反应为吸热还是放热,温度变化不能确定移动方向,则不能确定平衡常数的变化,故A错误;
B.如加入3olH2和1molCO2,二者的转化率相等,此时加入1molH2和1molCO2,n(H2):n(CO2)<3:1,加入CO2的量相对较多,则达到平衡时,H2的转化率将高于CO2,故B正确;
C.加入催化剂不能改变平衡移动,故C错误;
D.如在恒容条件下进行,随着反应进行,容器的压强逐渐减小,但在体积可变的容器中进行,压强不变,相当于在原来的基础上增大压强,有利于平衡向正反应方向移动,则达到平衡时乙醇的体积分数大于a,故D正确.
故选BD.
本题难度:一般
3、填空题 一定温度下,将2mol A和2mol B两种气体混合于体积为2 L的某恒容的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g), xC(g)+2D(g),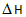 <0,2min 末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白: <0,2min 末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)X的值等于_________,
(2)该反应的化学平衡常数K=_________,升高温度时K值将_________(填“增大”、“减小”、“不变”)
(3)A物质的转化率为_________。
(4)若维持温度不变,在原平衡混合物的容器中再充入3mol C和3mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为_________mol;达新平衡时,A的物质的量为n(A)=_________mol。
参考答案:(1)2
(2)0.5;减小
(3)60%
本题解析:
本题难度:一般
4、选择题 一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( ) aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
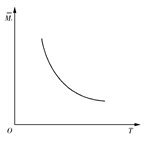
A.温度升高,平衡常数K减小
B.化学计量数a为1
C.维持温度不变,若起始时向容器中加入a mol Z、1 mol W反应达到平衡后放出的热量为Q2 kJ,则Q1+Q2=Q且Q>Q1>Q2
D.X的转化率α=Q1/Q
参考答案:C
本题解析:该反应为放热反应,温度升高,平衡逆向移动,K减小, r减小,说明2+1>a+1,则a=1,A、B正确;C中两平衡等效,则Q1+Q2=Q,但不知α的大小,故无法比较Q1与Q2的大小,C错误;物质转化的物质的量与放出的热量成正比,D正确。 r减小,说明2+1>a+1,则a=1,A、B正确;C中两平衡等效,则Q1+Q2=Q,但不知α的大小,故无法比较Q1与Q2的大小,C错误;物质转化的物质的量与放出的热量成正比,D正确。
本题难度:一般
5、计算题 把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算 2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算
(1)x?????????????????????(2) B的转化率
(3) 平衡时A的浓度???????(4) 恒温达平衡时容器内的压强与开始时压强比
参考答案:(1)2?????(2)20℅??????(3) 0.75
本题解析:
试题分析:(1)D的物质的量为n(D)=0.1mol?(L?min)-1×5min×4L=2mol,物质的量之比等于化学计量数之比,所以2:x=2mol:2 mol,解得x=2,
答:x的值是2;
(2)参加反应的B的物质的量n(B)=1/2n(C)=(1/2)×2mol=1mol,所以B的转化率为α=1mol÷5mol×100%=20%,
答:B的转化率为20%;
(3)△n(A)=(3/2)×2mol=3mol,n(A)平衡=n(A)起始-△n(A)=6mol-3mol=3mol,所以c(A)平衡= n(A)平衡÷V=3mol÷4L=0.75mol/L,
答:平衡时A的物质的量浓度为0.75mol/L;
(4)3A(g)+B(g) 2C(g)+2D(g),即反应前总的物质的量相等,根据压强之比等于物质的量之比,故恒温达平衡时容器内的压强与开始时压强比为1:1。 2C(g)+2D(g),即反应前总的物质的量相等,根据压强之比等于物质的量之比,故恒温达平衡时容器内的压强与开始时压强比为1:1。
答:恒温达平衡时容器内的压强与开始时压强比为1:1。
点评:本题考查化学平衡的计算,题目难度不大,注意对基础知识的理解、积累。
本题难度:一般
|