微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列变化必须加入其他物质作氧化剂才能发生的是(???)
A.HClO HCl
HCl
B.CO2 C
C
C.I- I3-
I3-
D.H2O H2
H2
参考答案:C
本题解析:
试题分析:A、氯元素由+1价变到-1价,化合价降低,被还原,需要加还原剂。B、碳元素由+4价变到0价,化合价降低,被还原,需要加还原剂。C、碘元素由-1价变到0价,化合价升高,被氧化,需要加氧化剂,故选C。
点评:本题是对氧化还原反应基本概念的考查,属于基础题。解题关键在于熟练掌握相关(氧化剂、还原剂、氧化产物、还原产物)的概念
本题难度:一般
2、选择题 下列表示物质结构的化学用语或模型正确的是
A.二氧化碳的结构式:O=C=O
B.HF的电子式: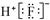
C.Cl-离子的结构示意图: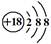
D.CH4分子的球棍模型:
参考答案:A
本题解析:
试题分析:A、二氧化碳分子中含有2个碳氧双键,所以二氧化碳的结构式为O=C=O,A正确;B、HF是含有极性键的共价化合物,电子式为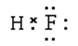 ,B不正确;C、氯离子的质子数是17,核外电子数是18,最外层电子数是3个,结构示意图为
,B不正确;C、氯离子的质子数是17,核外电子数是18,最外层电子数是3个,结构示意图为 本题难度:简单
本题难度:简单
3、选择题 下列变化属于化学变化的是
①钝化??②煤的气化??③煤的干馏??④石油的裂化?⑤石油的分馏
A.全是
B.除②③外
C.除②⑤外
D.除⑤外
参考答案:D
本题解析:略
本题难度:一般
4、选择题 将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.参加反应的硝酸的物质的量为0.4mol
B.加入合金的质量可能为9.6g
C.沉淀完全时消耗NaOH溶液体积为150mL
D.溶解合金时产生NO气体体积0.224L(以标准状况)
参考答案:A
本题解析:
试题分析:A、镁、铜都是2价金属,所以生成沉淀的化学式为M(OH)2,则沉淀的质量比合金质量增加的5.1g,也即氢氧根离子的质量,所以沉淀的物质的量是5.1g/17g/mol/2=0.15mol,则合金的物质的量是0.15mol,反应中失去电子的物质的量是0.15mol×2=0.3mol,根据得失电子守恒,生成NO的物质的量是0.3mol/3=0.1mol,所以被还原的硝酸的物质的量是0.1mol,未不含有的硝酸的物质的量是合金物质的量的2倍,为0.3mol,所以参加反应的硝酸的物质的量是0.1+0.3=0.4mol,正确;B、0.15mol的合金若全部是镁,则质量是3.6g,若全部是铜,则质量是9.6g,所以合金的质量介于3.6-9.6g之间,错误;C、沉淀完全时消耗氢氧化钠的物质的量也是沉淀中氢氧根离子的物质的量是5.1g/17g/mol=0.3mol,所以消耗氢氧化钠的体积是0.3mol/3mol/L=0.1L=100mL,错误;D、产生NO的物质的量是0.1mol,标准状况下的体积是2.24L,错误,答案选A。
考点:考查合金与硝酸反应的分析与计算
本题难度:一般
5、填空题 写出下列化学反应的方程式
(1)实验室制取二氧化碳的反应________________________,
(2)氯气与氢氧化钠反应________________________,
(3)氧化铝跟氢氧化钠溶液的反应(写离子反应方程式)________________________。
(4)漂白粉在空气中漂白原理________________________。
参考答案:(1)CaCO3+2HCl==CO2↑+CaCl2+H2O
本题解析:
本题难度:一般