微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据下列物质中硫的化合价判断,下列说法中错误的是
A.H2SO4具有氧化性
B.H2SO4具有还原性
C.H2S具有还原性
D.S既有还原性,又有氧化性
参考答案:B
本题解析:略
本题难度:简单
2、简答题 (6分)用17.4g二氧化锰和足量的浓盐酸充分反应后,列式计算被氧化的HCl的质量是多少?
参考答案:14.6g
本题解析:
试题分析:17.4g二氧化锰的物质的量为17.4g÷87g/mol=0.2mol,设参加反应的盐酸物质的量为x,
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4 1
x 0.2mol 得:x=0.8mol 反应中只有2个氯原子化合价发生改变,故反应中只有一半的HCl做还原剂,故被氧化的HCl物质的量为0.4mol,,质量为:0.4mol×36.5g/mol=14.6g.
考点:物质的量在化学方程式中的应用。
本题难度:一般
3、填空题 (16分)某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:

已知:
①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-:
②)TiOSO4水解的反应为:TiOSO4+(x+1)H2O=TiO2?xH2O↓+H2SO4
请回答:
(1)步骤①所得滤渣的主要成分为__________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比_______。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是______________________。
(5)已知:FeCO3(s)  Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________。
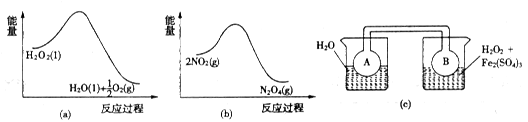
参考答案:(16分) (1)TiO2?xH2O、Fe(2分);(2)1
本题解析:
试题分析:(1)在反应废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,向其中加入Fe屑,发生反应:Fe2(SO4)3+Fe= 3FeSO4; Fe+H2SO4= FeSO4+ H2↑; 随着反应的进行,溶液的酸性减弱,TiOSO4发生水解反应: TiOSO4+(x+1)H2O=TiO2?xH2O↓+H2SO4;所以得到的滤渣成分是TiO2?xH2O;(2) ③FeSO4溶液蒸发浓缩,冷却结晶得到绿矾,然后将其在空气中煅烧,发生反应:4FeSO4+O2 2Fe2O3+4SO3,生成铁红和三氧化硫,该反应中氧化剂是O2,还原剂是FeSO4。由于在氧化还原反应中电子转移守恒,所以氧化剂与还原 剂的物质的量之比1:4;(3)步骤④是FeSO4溶液中加入NH4HCO3,来制取FeCO3,需控制反应温度低于35℃,是为了防止NH4HCO3分解及减少Fe2+的水解反应的发生;(4)步骤④反应的离子方程式是Fe2+ + 2HCO3一="=" FeCO3 ↓+ H2O + CO2 ↑;(5) FeCO3难溶于水,但是在水中也有一定的溶解度,因此在溶液中存在沉淀溶解平衡:FeCO3(s)
2Fe2O3+4SO3,生成铁红和三氧化硫,该反应中氧化剂是O2,还原剂是FeSO4。由于在氧化还原反应中电子转移守恒,所以氧化剂与还原 剂的物质的量之比1:4;(3)步骤④是FeSO4溶液中加入NH4HCO3,来制取FeCO3,需控制反应温度低于35℃,是为了防止NH4HCO3分解及减少Fe2+的水解反应的发生;(4)步骤④反应的离子方程式是Fe2+ + 2HCO3一="=" FeCO3 ↓+ H2O + CO2 ↑;(5) FeCO3难溶于水,但是在水中也有一定的溶解度,因此在溶液中存在沉淀溶解平衡:FeCO3(s)  Fe2+(aq)+CO32-(aq),当向其中加入乳酸时,乳酸电离出的H+与CO32一反应,形成HCO3-,降低了CO32一的浓度,使上述沉淀溶解平衡正向移动,使碳酸亚铁溶解得到乳酸亚铁溶液;(6)在溶液B中含有SO42一,常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生氧化反应,该电极的电极反应可表示为2SO42--2e-==S2O82-;(7)根据图a可知H2O2的负极反应是放热反应,反应2NO2
Fe2+(aq)+CO32-(aq),当向其中加入乳酸时,乳酸电离出的H+与CO32一反应,形成HCO3-,降低了CO32一的浓度,使上述沉淀溶解平衡正向移动,使碳酸亚铁溶解得到乳酸亚铁溶液;(6)在溶液B中含有SO42一,常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生氧化反应,该电极的电极反应可表示为2SO42--2e-==S2O82-;(7)根据图a可知H2O2的负极反应是放热反应,反应2NO2 N2O4的正反应是放热反应。在装置c的左边烧内放有水,在右边的烧杯内放有H2O2和Fe2(SO4)3的混合溶液,因为Fe3+对H2O2的分解具有催化作用,所以H2O2会不断分解,放出热量没事右边的烧杯内的水的温度升高。根据平衡移动原理:升高温度,平衡向吸热的逆反应方向移动,NO2浓度增大,所以连通器内的气体颜色加深。
N2O4的正反应是放热反应。在装置c的左边烧内放有水,在右边的烧杯内放有H2O2和Fe2(SO4)3的混合溶液,因为Fe3+对H2O2的分解具有催化作用,所以H2O2会不断分解,放出热量没事右边的烧杯内的水的温度升高。根据平衡移动原理:升高温度,平衡向吸热的逆反应方向移动,NO2浓度增大,所以连通器内的气体颜色加深。
考点:考查生产钛白粉产生的废液的综合利用的知识。主要包括物质的分离、氧化还原反应中物质的关系、盐的水解、沉淀溶解平衡、原电池反应原理、反应热的综合利用及温度对可逆反应的平衡移动的影响。
本题难度:困难
4、选择题 下列单质或化合物性质的描述正确的是
A.NaHSO4水溶液显中性
B.SiO2与酸、碱均不反应
C.NO2溶于水时发生氧化还原反应
D.Fe在足量Cl2中燃烧生成FeCl2和FeCl3
参考答案:C
本题解析:硫酸氢钠在水溶液中完全电离为:NaHSO4=Na++H++SO42-,故溶液呈酸性,A错;二氧化硅属于酸性氧化物,其能和强碱反应,也能和氢氟酸反应,B错;二氧化氮溶于水和水反应生成硝酸和一氧化氮,属于氧化还原反应,C对;氯气具有较强的氧化性,铁在其中燃烧一定生成氯化铁,D错。
【考点定位】此题以元素化合物知识为基础,综合考查了物质性质、氧化还原反应等知识。
本题难度:一般
5、选择题 网络、报纸等媒体爆料的下列造假事件中,肯定涉及化学变化的是( )
A.用硫磺燃烧来熏蒸粉丝使其变白
B.用工业石蜡等给瓜子“美容”
C.用淀粉、蔗糖、奶香精等掺和成“奶粉”
D.用铜粉和锌粉熔合成“黄金”
参考答案:A
本题解析:硫磺燃烧产生的SO2具有漂白性,所以能用来熏蒸粉丝使其变白,属于化学变化,其余都是物理变化,答案选A。
本题难度:简单