微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应N2O4(g)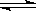 2NO2(g)⊿H = +57KJ/mol,在温度为
2NO2(g)⊿H = +57KJ/mol,在温度为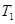 、
、 时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 (??????????)
时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 (??????????)
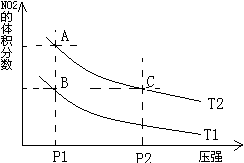
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
参考答案:C
本题解析:A、C两点:在相同温度下,P2>P1,则应υ(C) >υ(A),故A错误;
由于C点压强大,那么容器体积是减小的,所以气体被压缩,则看起来C点颜色深了,尽管C中NO2的体积分数比A小,但是平衡移动是微弱的,比不过体积改变对颜色的影响,故B错误;
C项,加热,平衡右移,正确;
平均相对分子质量=气体总质量/气体总物质的量,气体总质量不变,而由A点到C点,压强增大,平衡左移,所以气体总物质的量减小,则气体的平均相对分子质量增大,即:C>A,故D错误;
本题难度:一般
2、选择题 将4 mol A 气体和2 mol B 气体在2 L的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g) ?2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列说法中正确的是( )
?2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列说法中正确的是( )
①用物质A表示的反应的平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③反应达到平衡时,A、B、C的反应速率一定相等????
④反应达到平衡时,A、B、C的物质的量均不再变化
A.①③?????? B.①④??????? C.②③????????? D.③④
参考答案:B
本题解析:C的速率为0.6mol/L÷2s=0.3mol/(L·S),速率之比等于计量系数之比,故①正确;达到平衡状态,正反应速率等于逆反应速率,各物质的量不变,故④正确。
本题难度:一般
3、填空题 钢铁是21世纪用途最广的结构材料和功能材料。其成分主要是Fe和少量C。
(1)工业上在炼铁高炉中用CO热还原Fe2O3冶炼铁。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目????????????????????????????????????????。
(2)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图(黑球代表Fe,白球代表Mg)。则铁镁合金的化学式为????????。

(3)Fe3+的电子排布式为??????????;CH3+微粒的中心原子杂化轨道类型为?????????;
(4)向一定量的FeCl3溶液中加入适量KSCN溶液,溶液变红色。该反应体系中存在化学平衡??????????????????????????????????(用反应式表示);向上述红色溶液中加入Mg(OH)2固体,可观察到溶液红色变浅,有红褐色沉淀析出。试用平衡移动原理解释该现象?????????????。(不考虑SCN—与Mg2+反应)
参考答案:
(1) 本题解析:
本题解析:
试题分析:(1)根据元素守恒和质量守恒定律,不难写出相关化学方程式和画出单线桥;(2)利用均摊法,
Fe:8× +6×
+6× =4;Mg:8;得到铁镁合金化学式:FeMg2;(3)根据能量最低原理和核外电子排布原理,不难写出Fe3+,核外电子排布式;CH3+微粒的中心原子C,含有3δ,孤电子对数:
=4;Mg:8;得到铁镁合金化学式:FeMg2;(3)根据能量最低原理和核外电子排布原理,不难写出Fe3+,核外电子排布式;CH3+微粒的中心原子C,含有3δ,孤电子对数: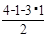 =0,
=0,
价层电子对数为4,杂化轨道类型SP2。(4)存在平衡Fe3++3SCN- Fe(SCN)3,根据勒夏特列原理不
Fe(SCN)3,根据勒夏特列原理不
难判断化学平衡的移动方向。
本题难度:一般
4、选择题 一定条件下反应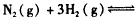
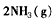 在10 L的密闭容器中进行,测得2 min内,N2的物质的量由20 mol减小到8 mol,则2 min内N2的反应速率为 [???? ]
在10 L的密闭容器中进行,测得2 min内,N2的物质的量由20 mol减小到8 mol,则2 min内N2的反应速率为 [???? ]
A.1.2 mol/(L·min)
B.1 mol/(L·min)
C.0.6 mol/(L·min)
D.0.4 mol/(L·min)
参考答案:C
本题解析:
本题难度:简单
5、计算题 按要求完成下列各小题。???
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为: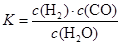 ?
?
它所对应的化学方程式为:????????????????????????????????????????????????。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。
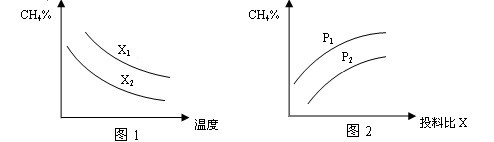
①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:?????????
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:
????????????????。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb=??????????。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
参考答案:(14分毎空2分)
Ⅰ、(1) C(S)+H2O(g)
本题解析:
试题分析:Ⅰ、(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据平衡常数的表达式可知,该反应的化学方程式是C(S)+H2O(g) H2(g)+CO(g)。
H2(g)+CO(g)。
(2)①根据反应的化学方程式CH4+H2O CO+3H2可知,在温度相同时,投料比越大,甲烷的转化率越低,则容器中甲烷的含量越高,所以根据图像1可知,X2<X1。
CO+3H2可知,在温度相同时,投料比越大,甲烷的转化率越低,则容器中甲烷的含量越高,所以根据图像1可知,X2<X1。
②根据方程式可知,该反应是体积增大的,所以在投料比相同的条件下,压强越大,甲烷的转化率越小,则甲烷的含量越高,所以根据图 2可知,P2<P1。
(3)①在该燃料电池中,甲烷在负极通入,氧气在正极通入。参加反应的氧气是0.2mol,得到0.8mol电子,所以消耗甲烷的物质的量是0.8mol÷8=0.1mol,生成CO2是0.1mol,但溶液中氢氧化钾是0.15mol,所以反应中生成碳酸钾和碳酸氢钾,且二者的物质的量均是0.05mol。由于CO32-的水解程度大于HCO3-的水解程度,所以放电后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>cCO32-)>c(OH-)>c(H+)。
②原电池中负极失去电子,所以葡萄糖在负极放电,电极反应式是C6H12O6-24e-+6H2O=6CO2+24H+。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,所以该温度下水的离子积常数=1×10-13,所以pH=12的NaOH溶液中OH-的浓度是0.1mol/L。所得混合液为中性,这说明二者恰好反应,则VaL×0.01mol/L=VbL×0.1mol/L,解得Va︰Vb=10︰1。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,因此根据电荷守恒可知,溶液中c(CH3COO-)=c(Na+)=0.01mol/L,则溶液中c(CH3COOH)=(0.5c-0.01)mol/L。又因为溶液中c(H+)=1×10-7mol/L,所以根据醋酸的电离常数表达式可知Ka=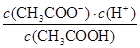 =2×10-9/(c-0.02)。
=2×10-9/(c-0.02)。
本题难度:困难