微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是
A.1mol NH3所含有的原子数为NA
B.常温常压下,22.4L氧气所含的原子数为2NA
C.常温常压下,48g O3所含的氧原子数为3NA
D.1 L 0.1mol/LNaCl溶液中所含的Na+为NA
参考答案:C
本题解析:根据氨气的化学式可知,1molNH3中含有3mol原子,A不正确;常温常压下,22.4L氧气不是1mol,B不正确;48g臭氧是1mol,含有3mol氧原子,C正确;D中氯化钠的物质的量是0.1mol,含有钠离子是0.1mol,D不正确,答案选D。
本题难度:简单
2、选择题 有Na2CO3、NaHCO3、CaO和NaOH组成的混合物28.2g,把它们溶于足量的水,充分反应后,溶液中Ca2+、CO32—、HCO3—均转化为沉淀,将容器中的水分蒸干,最后得到白色固体物质共30g。则下列有关叙述错误的是
A.原混合物中含Na2CO3 0.1 mol
B.原混合物中n(Na2CO3)+n(NaHCO3)=n(CaO)
C.30g固体中一定存在n(CaCO3)<n(NaOH)
D.不能确定原混合物中NaOH的质量
参考答案:
本题解析:
试题分析:由于溶液中Ca2+、CO32-、HCO3-全部转化为沉淀,所以,后得到白色固体30g应为碳酸钙和氢氧化钠的混合物。可看作发生了以下反应:Na2CO3+CaO + H2O=CaCO3 +2NaOH;NaHCO3+CaO+H2O=CaCO3 +NaOH + H2O,由此可以看出:固体质量的变化仅由反应Na2CO3+CaO + H2O=CaCO3 +2NaOH造成。
Na2CO3+CaO + H2O=CaCO3 +2NaOH
106?????????? 18
x???????
本题难度:一般
3、选择题 下列有关0.1 mol·L-1 KNO3溶液的叙述正确的是(???)
A.1 L该溶液中含有KNO3 101 g
B.100 mL该溶液中含有NO 0.01 mol
0.01 mol
C.从1 L该溶液中取出100 mL,所取出的KNO3溶液的浓度为 0.01 mol·L-1
D.在1 L水中溶解10.1 g KNO3,即可配制得0.1 mol·L-1 KNO3溶液
参考答案:B
本题解析:浓度是0.1mol/L,则1L溶液中含有溶质是0.1mol,质量是10.1g,A不正确;由于溶液是均一、稳定的,所以B、C中浓度是不变的,因此B正确,C不正确;D不正确,因为1L是指溶液的体积,而不是溶剂的体积,答案选B。
本题难度:一般
4、填空题 现有由等质量的NaHCO3和KHCO3组成的混合物a g,与100 mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的物质的量之比为???????。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸中HCl的物质的量为???????mol。
(3)如果盐酸过量,生成CO2的体积为???????L;
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道????????????????????????????????????????????????????????。
(5)若NaHCO3和KHCO3不是以等质量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是???????????????。
参考答案:(1)100∶84(或25∶21)
(2) ![]()
本题解析:(1)质量相等时,物质的量与摩尔质量成反比,所以二者的物质的量之比是100∶84(或25∶21)。
(2)混合物中NaHCO3和KHCO3的物质的量分别为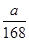 ?mol与
?mol与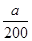
本题难度:一般
5、选择题 用98%的浓H2SO4(密度为1.84?g/mL)配制1?mol/L的稀H2SO4?100mL,配制过程中可能用到下列仪器:①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒。按使用出现的先后顺序排列正确的是??[???? ]
A.②⑥③⑦⑤?????
B.④③⑤⑦⑥?????
C.①③⑦⑤⑥?????
D.②⑤⑦⑥
参考答案:A
本题解析:
本题难度:简单