微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
参考答案:CD
本题解析:考查中和滴定误差分析
A:滴定终点读数时,俯视滴定管的刻度,导致读数偏小,标准溶液体积偏小,测定结果偏低
B:操作正确,测定结果正确
C:导致标准溶液体积偏大,测定结果偏高
D:导致标准溶液浓度偏小,标准溶液体积偏大,测定结果偏高
答案为CD
本题难度:一般
2、选择题 要配制1 mol·L-1的NaOH溶液100mL,下面操作正确的是
A.称取8g NaOH固体,放入烧杯里,用量筒量取100mL 蒸馏水倒入烧杯中,搅拌充分溶解
B.称取8g NaOH固体,放入100mL量筒中,加水,充分溶解并稀释至100mL
C.称取8g NaOH固体,放入100mL容量瓶中,加蒸馏水溶解,再加水至刻度线,盖好瓶塞,反复摇匀。
D.称取8g NaOH固体,放入烧杯里,加适量水溶解,将溶液转移到容量瓶中,洗涤烧杯和玻璃棒,把洗液一并转移到容量瓶中,再加水将溶液体积调至100mL
参考答案:D
本题解析:A错,配制一定体积浓度准确的溶液要用容量瓶;B错,量筒不能用于配制溶液,只能量取液体;C错,用容量瓶配制溶液时,溶解溶质是在烧杯中进行,不用直接放在容量瓶中溶解;D正确;
本题难度:一般
3、选择题 用已知物质的量浓度的NaOH溶液滴定未知物质的量浓度的醋酸,下列判断滴定终点的方法正确的是
A.用酚酞作指示剂,滴定至溶液由无色变为红色,并在半分钟内不褪色
B.用甲基橙作指示剂,滴定至溶液由红色开始变为橙色
C.用石蕊作指示剂,滴定至溶液由红色开始变为紫色
D.在滴定过程中,用玻璃棒蘸取试液,涂抹在pH试纸上,至混合液pH为8
参考答案:A
本题解析:在选择指示剂时要尽可能使指示剂的变色范围和滴定终点时的pH保持一致,且颜色一般由浅变深以便于观察。因此最佳的是酚酞。答案选A。
本题难度:一般
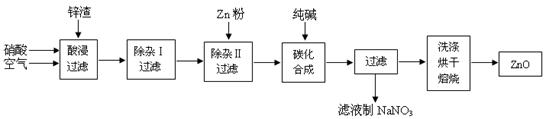
4、填空题 氧化锌粉末广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃等行业,为综合应用资源,常从冶炼锌、锌制品加工企业回收的锌渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如图:
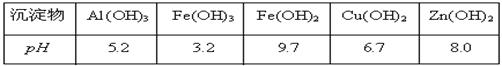
有关氢氧化物沉淀完全的pH见下表:
(1)在酸浸过程中,常将锌渣碎成粉末并通入空气,同时保持酸过量,理由是?????。
(2)上述工艺多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、??????。
(3)①在“除杂Ⅰ”中,常用酸性KMnO4溶液,其目的是??????????,KMnO4是该反应的?????(氧化剂、还原剂)。将溶液的pH调至4,目的是??????????????????????。
②在“除杂II”中,加入锌粉的目的是???????????????????????????????????。
(4)在“碳化合成”中,产物中有碱式碳酸锌[Zn2(OH)2CO3]和CO2等,请写出该反应的化学方程式?????????????????????????????????????????????????????。
(5)本工艺中,过滤分离次数较多,其明显的缺陷是?????????????????????????。
参考答案:(1)增大反应面积,加快反应速率(2分);保证锌渣充分反应。
本题解析:
试题分析:(1)酸浸采取的措施与加快反应速率、提高浸出率或原料的利用率;
(2)过滤需要漏斗、玻璃棒、烧杯等玻璃仪器;
(3)酸性高锰酸钾溶液具有强氧化性,将Fe2+转化成为Fe3+,调节pH使Fe3+ 完全转化为Fe(OH)3沉淀;锌比铜活泼,可以除去溶液中的Cu2+(或调节溶液的pH值);
(4)由原子守恒可知,2Na2CO3+2Zn(NO3)2+H2O=4NaNO3+Zn2(OH)2CO3+CO2↑;
(5)过滤次数较多,锌元素损失较多,降低产率。
本题难度:一般
5、选择题 下列仪器使用前必须检查其是否漏水的是
①分液漏斗②蒸馏烧瓶③冷凝管④容量瓶⑤蒸发皿⑥长颈漏斗
A.②⑥
B.①④
C.③④
D.③⑤
参考答案:B
本题解析:略
本题难度:一般