微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验操作或描述中正确的是 [???? ]
①用瓷坩埚高温熔融Na2CO3固体 ②用溴水检验汽油中是否含有不饱和脂肪烃 ③用pH试纸测定氯水的pH
④用盐析的方法分离提纯蛋白质 ⑤用加热的方法提纯含有少量碳酸氢钠的碳酸钠固体 ⑥用25 mL 的碱式滴定管量取14. 80 mL稀NaOH溶液
A.②④⑤⑥
B.①③
C.①②④⑤
D.②③④⑤
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列有关实验原理、操作及安全知识的叙述,正确的是
A.不慎将苯酚固体粉末沾在皮肤上,立即用大量热水(>65℃)冲洗
B.在用标准盐酸滴定未知浓度NaOH溶液时,滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失,会使测定结果偏低
C.把玻璃管插入橡胶塞孔时,可用厚布护手,紧握用水湿润的玻管,缓慢旋进塞孔中
D.银氨溶液、Cu(OH)2悬浊液、硫酸溶液、氯水在实验室里均不宜长期放置
参考答案:C
本题解析:
正确答案:C
A、不正确,形成溶液后,污染面积更大;B、不正确,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失,气泡的体积,也当成的标准盐酸的体积,会使测定结果偏高; C、正确,玻璃管易碎,注意安全,防止玻璃管折断时划伤手;D、不正确,其中硫酸性质稳定,可以长时间保存。
本题难度:一般
3、实验题 (13分)用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+ H2SO4(85%)=Na2SO4 + SO2↑+ H2O
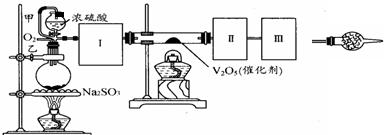
根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合Ⅰ、Ⅱ、Ⅲ处连接的装置分别是????????????、?????????????、??????????。

(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,首先应采取的操作是????????????????????????????????????。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(写2点)。
①原因??????????????????,验证方法?????????????????????????????????????
②原因??????????????????,验证方法?????????????????????????????????????
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式????????????????????????????????????????????
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为???????????????%(用含a、b的代数式填写)
参考答案:13分)(1) B A E(2分,错写1个扣1分,至0分,其
本题解析:略
本题难度:一般
4、选择题 下列有关试剂的保存方法,错误的是
A.浓硝酸保存在无色玻璃试剂瓶中
B.氢氧化钠溶液保存在橡皮塞的玻璃试剂瓶中
C.少量的钠保存在煤油中
D.新制的氯水通常保存在棕色玻璃试剂瓶中
参考答案:A
本题解析:
试题分析:A、浓硝酸见光或受热易分解,应保存在棕色玻璃试剂瓶中,错误;B、氢氧化钠溶液保存在橡皮塞的玻璃试剂瓶中,正确;C、少量的钠保存在煤油中,正确;D、新制的氯水中的次氯酸见光易分解,通常保存在棕色玻璃试剂瓶中,正确。
本题难度:一般
5、填空题 (12分)某化学实验小组从商店买回的浓硫酸试剂标签的部分内容破损。由于试剂瓶口密封签已破损,他们怀疑该硫酸的质量分数与标签不符,决定开展研究。部分破损标签内容为硫酸:化学纯(CP) 品名:硫酸, 化学式:H2SO4?相对分子质量:98,质量分数:98%?密度:1.98 g/cm3。
甲同学认为,可以用一种精密仪器测量该溶液的c(H+),若c(H+)=36.8 mol·L-1,则该溶液的质量分数为98%。
乙同学认为,即使有精密的仪器,甲同学的方案也不行,建议用重量分析法来测定。具体设想:取一定体积的该硫酸与足量氯化钡溶液反应,过滤、洗涤、干燥沉淀,称量沉淀的质量。
丙同学则建议用中和滴定法进行测定,设想如下:①准确量取一定体积的硫酸,用适量的水稀释;②往稀释后的溶液中滴入几滴指示剂;③用碱式滴定管量取标准浓度的氢氧化钠溶液滴定,直到出现滴定终点为止;④记录消耗的氢氧化钠溶液的体积。
请回答下列问题:(1)乙同学推测甲同学的方案不可行的理由是______________(1分)
(2)乙同学的方案的关键操作有两点:①确保SO完全沉淀;②洗涤沉淀,确保沉淀不含杂质。在实际中,洗涤沉淀的操作方法是________________________________________;,
设计简单实验检验SO是否完全沉淀:_________________________________(2分)
(3)在丙同学的方案中步骤②用到的指示剂是________;达到滴定终点的标志是________________________________________________________________________。(2分)
(4)丙同学的方案中,下列操作对测定结果的影响无法确定的是________。(2分)
①在滴定前未用NaOH标准溶液润洗滴定管,②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,③锥形瓶用蒸馏水洗净后,没有用待测液润洗,④滴定前,仰视读数,滴定后,仍仰视读数,⑤滴定前,仰视读数,滴定后俯视读数
(5)丙同学在实验中,分别取等体积原硫酸,用NaOH溶液滴定三次,终点时,得到的NaOH溶液体积如下表所示:,
实验序号
| 硫酸体积
| NaOH溶液体积
| NaOH溶液浓度
|
①
| 5.00 mL
| 35.65 mL
| 5.00 mol·L-1
|
②
| 5.00 mL
| 39.65 mL
| 5.00 mol·L-1
|
③
| 5.00 mL
| 35.55 mL
| 5.00mol·L-1
通过计算,确认该浓硫酸质量分数与标签是否相符?________(填“相符”或“不相符”),理由(计算步骤)是______________________________________________________。(5分)
参考答案:(1)浓硫酸含水少,硫酸主要以分子形式存在
(2)通过
本题解析:本题考查探究的基本方法,设计浓硫酸的性质,酸碱滴定的操作和计算,过滤、洗涤的基本操作。(1)因为浓硫酸含水少,极少数能电离出H+,主要以分子形式存在,故不能测定;
(2)通过玻璃棒引流,向过滤器中注入蒸馏水,浸没沉淀,待水流出后,再注入蒸馏水,重复多次直到沉淀洗净为止 在上层清液中滴加氯化钡(或硝酸钡等)溶液,若产生白色沉淀,则说明SO没有完全沉淀;若不产生白色沉淀,则说明SO已完全沉淀
(3)强酸强碱的滴定可以使用酚酞或者甲基橙;
(4)①中未润洗,导致NaOH浓度减小,消耗体积增大,测定结果偏高,②滴定前后都有气泡,气泡所占的体积不确定,故不能确定,③为正确操作,没有影响,④两次虽均仰视,但仰视的角度是否一样,同样不能确定,⑤滴定钱仰视,滴定后俯视,是体积偏小,测定浓度偏小,故答案为②④;
(5)不相符 舍去误差大的数据(VNaOH=39.65 mL),可得==35.60 mL,根据标签数据计算得浓硫酸的物质的量浓度为c(H2SO4)= mol·L-1=19.8mol·L-1,根据中和滴定测得浓硫酸的浓度为c(H2SO4)=mol·L-1=17.8mol·L-1<19.8mol·L-1
本题难度:一般
|