微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是( )
A.1.00 mol NaCl中含有6.02×1023个NaCl分子
B.1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
D.电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠
参考答案:B
本题解析:解答本题时应注意通过物质的量和其他物理量之间的换算关系进行有关计算和判断,同时注意溶液配制时水的体积会发生变化。
选项
具体分析
结论
A
NaCl为离子化合物,不存在NaCl分子
错误
B
1.00 mol NaCl中含有1.00 mol Na+,而Na+的最外层电子数为8,所以 1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
正确
C
配制溶液时不能直接将溶质溶于一定体积的水中,而应该是溶于少量水中再加水稀释至所需体积
错误
D
电解58.5 g熔融的NaCl,只能得到0.5 mol氯气,即标准状况下11.2 L氯气
错误
本题难度:一般
2、选择题 NA为阿伏加德罗常数,下列说法正确的是?(????)??????????????????
A.标准状况下,11.2 L的己烷所含的分子数为0.5 NA
B.28 g乙烯所含共用电子对数目为4 NA
C.0.1molCnH2n+2中含有的C-C键数为0.1n NA
D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
参考答案:D
本题解析:标准状况下己烷不是气体,是液体,A不正确。根据乙烯的结构简式可知,乙烯中含有的共用电子对数目是6对,B不正确。根据通式可知C中有机物是烷烃,烷烃是链烃,含有的C-C单键是n-1个,C不正确。乙烯和丙烯都属于烯烃,最简式相同,都是CH2,所以2.8g含有的碳原子是 ,所以D正确。答案选D。
,所以D正确。答案选D。
本题难度:一般
3、选择题 1 mol Na2O2与2 mol NaHCO3固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3
B.Na2O2、Na2CO3
C.NaOH、Na2CO3
D.Na2O2、NaOH、Na2CO3
参考答案:A
本题解析:
试题分析:由题可知,该过程发生的反应为:2NaHCO3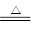 Na2CO3+H2O+CO2↑,
Na2CO3+H2O+CO2↑,
2Na2O2+2CO2=2Na2CO3+O2↑,2Na2O2+2H2O=4NaOH+O2↑,2 mol NaHCO3固体反应生成了1mol水和1mol二氧化碳,所以而生成的二氧化碳刚好与过氧化钠反应,而不与水反应,因为水加热被蒸发了,所以残留的固体物质是Na2CO3 ,故本题的答案选择A。
考点:钠及其化合物
点评:本题考查了钠及其化合物,该知识点是高考考查的重点和难度,本题比较抽象,有一定的难度。
本题难度:一般
4、选择题 下列有关阿伏加德罗常数(NA)的说法错误的是(???? )
A.32克O2所含的原子数目为2NA???
B.0.5molSO2含有的原子数目为1.5NA
C.0.5molSO2含有的分子数目为1.5NA
D.0.5NA个氯气分子(标况下)的体积是11.2L
参考答案:C
本题解析:考查阿伏加德罗常数的应用。32g氧气的物质的量是1mol,所以含有2mol氧原子,选项A正确;SO2是由1个S原子和2个氧原子构成的,共计含有3个原子,所以0.5molSO2含有的原子数目为1.5NA,选项B正确;选项C不正确,0.5molSO2含有的分子数目为0.5NA;根据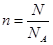 可知,0.5NA个氯气分子的物质的
可知,0.5NA个氯气分子的物质的
本题难度:一般
5、计算题 有一种氯化钠与氯化钾的混合物,它所含钾与钠的物质的量之比为3∶1。求:
(1)混合物中氯化钾的质量分数。
(2)含1 mol Cl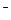 的该混合物的质量。
的该混合物的质量。
参考答案:(1)79.3%? (2)70.5 g
本题解析:(1)NaCl与KCl的物质的量之比等于Na与K的物质的量之比。
则n(NaCl)∶n(KCl)=1∶3。
设NaCl为1 mol,则KCl为3 mol。
则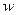 (KCl)=
(KCl)= 本题难度:简单
本题难度:简单