微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某工厂的废水中含有FeSO二、H八SO二、Ag八SO二、Al八(SO二)3及一些污泥.某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下:
表一废水中各物质的含量
| 物质 | FeSO二 | H八SO二 | Ag八SO二 | Al八(SO二)八 | 污泥
质量分数/(%)
15.六
7.六
六.二六
六.3二
5.六
表二??FeSO二和Al八(SO二)3在水中的溶解度
| 温度/℃ | 六 | 1六 | 八六 | 3六 | 二六 | 5六
FeSO二溶液度(g)
15.6
八六.5
八6.5
3八.9
二六.八
二8.6
Al八(SO二)3溶解度(g)
31.八
33.5
36.二
二六.二
二5.7
5八.八
该课题组根据表中数据,设计了污水处理方案,拟利用该厂的废铁屑(有少量锈斑)、烧碱溶液和硫酸处理此污水,回收FeSO二?7H八O和Ag.
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是______.
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③______,目的是使Ag+全部还原为金属Ag;
④______,目的是分离出Ag;
(八)请写出后续的步骤,除去Al3+,得到主要成分为FeSO二?7H八O晶体.
⑤将第______步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-二后,______,滤出FeSO二?7H八O晶体
(3)写出步骤③中所有化学反应的离子方程式______.
(二)在步骤⑤中,加入少量硫酸调节pH的目的是______.
参考答案:(1)①带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤洗去
本题解析:
本题难度:一般
2、选择题 下列叙述中,正确的是 [???? ]
A.溶度积大的化合物溶解度肯定大
B.向含有AgCl固体的溶液中加入适量的水使溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变
C.将难溶电解质放入水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.AgCl水溶液的导电性很弱,所以AgCl为弱电解质
参考答案:B
本题解析:
本题难度:一般
3、选择题 常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
A.同物质的量浓度的三种溶液的pH:a>b>c
B.同pH时,三种溶液稀释相同倍数后,pH:a<b<c
C.同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c
D.同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
参考答案:A
本题解析:
试题分析:氢氧化钡是二元强碱,氢氧化钠是一元强碱,氨水是一元弱碱,所以在物质的量浓度相等的条件下,溶液的pH应该是a>b>c,A正确;在稀释过程中,促进氨水的电离,所以同pH时,三种溶液稀释相同倍数后,pH应该是a=b<c,B不正确;同pH、同体积的三种溶液消耗同浓度盐酸的体积应该是a=b<c,C不正确;同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数应该是a=b<c,D不正确,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的
本题难度:简单
4、填空题 如图所示,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42—离子物质的量浓度的对数,回答下列问题。
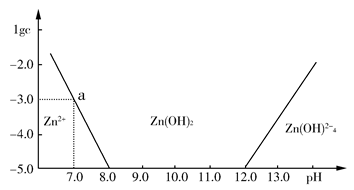
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
(4)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
c(HCl)/( mol·L-1)
| 0.50
| 1.00
| 2.04
| 2.90
| 4.02
| 5.16
| 5.78
| c(PbCl2)/( mol·L-1)×10-3
| 5.10
| 4.91
| 5.21
| 5.90
| 7.48
| 10.81
| 14.01
?
根据上表数据判断下列说法正确的是________(填字母序号)。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
参考答案:(1)Zn2++4OH-=Zn(OH)42— (2)10-1
本题解析:(1)由图可知:pH在8.0~12.0时,Zn2+主要以Zn(OH)2存在。pH>12.0时,Zn(OH)2转化为Zn(OH)42—。
(2)Ksp=c(Zn2+)·c2(OH-),当pH=7时,c(Zn2+)=10-3 mol·L-1,即Ksp=10-3·(10-7)2=10-17。
(3)由图知,应控制pH范围8.0~12.0。
(4)由表中数据可知,当Cl-浓度由小变大时,PbCl2的溶解度会先变小后变大,说明当Cl-增加到一定浓度时,PbCl2可以与Cl-形成某种离子(如配
本题难度:一般
5、选择题 难溶电解质AB2饱和溶液中,c(A+)=x mol·L-1,c(B-)=y mol·L-1,则Ksp值为[???? ]
A.1/2xy2
B.xy
C.xy2
D.4xy2
参考答案:C
本题解析:
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772