9×10-6
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④向沉淀中加入足量的盐酸。
(1)步骤①所得悬浊液中[Ca2+]=________ mol·L-1
(2)写出第②步发生反应的离子方程式:________________________________.
(3)设计第③步的目的是________________________________________________.
(4)第④步操作发生的现象为: 。
参考答案:(1)0.003
(2)CO32- (aq)+CaSO
本题解析:
试题分析:步骤①产生白色沉淀,确定为CaSO4,根据其Ksp解得[Ca2+] =0.003 mol/L;结合两者的溶度积确定当加入固体Na2CO3时,产生CaCO3,确定②的离子方程式为CO32- (aq)+CaSO4(s)=SO42- (aq)+CaCO3(s) 。
考点:难溶盐的溶度积、
本题难度:困难
2、填空题 【化学——选修2:化学与技术】(15分)
某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:

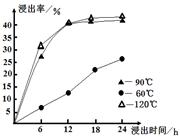
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4;
CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
参考答案:(除标记外每空2分,共15分)
(1)12
本题解析:
试题分析:(1)根据五行可知,温度太低浸出率较低,而90℃与120℃时的浸出率差不太多,而温度太高消耗的能量较多,生产成本大,所以最佳的温度是90℃,12小时时浸出率基本达到最大,再增长时间,浸出率增大不多,所以最佳的浸出时间是12小时;
(2)该反应不是氧化还原反应,所以只需按照质量守恒定律配平即可,Fe元素守恒,则硫酸铁的系数是3,Na2Fe6(SO4)4(OH)12的系数是1,则硫酸钠的系数是5,所以碳酸钠的系数是6,二氧化碳为6,水是6;
(3)加入过量NaF溶液,则生成MgF2和CaF2沉淀,则滤液为二者的饱和溶液,溶液中的氟离子浓度相等,所以滤液中的c(Ca2+)/c(Mg2+)= KSP(CaF2)/ KSP(MgF2)= 1.11×10-10/7.4×10-11=1.5;
(4)根据流程图分析,除铁、钙、镁的过程中都生成硫酸钠,加入草酸铵后生成草酸钴沉淀,则该沉淀中可能存在的杂质离子有SO42-、NH4+、Na+;将得到的沉淀洗涤以除去杂质离子,然后低温干燥,防止草酸钴分解;
(5)充电时,Li+还原为Li,则LiCoO2中Li的化合价是+1价,所以LiC6中Li的化合价Li的化合价是0价;放电时正极发生还原反应,则CoO2得到1个电子与锂离子结合为LiCoO2,所以放电时有1mole-转移,则有1mol LiCoO2生成,正极CoO2增加的质量即为1molLi的质量为7g。
考点:考查对图像的分析判断,化学方程式的配平,溶度积的应用,电化学反应原理的应用
本题难度:困难
3、选择题 已知25℃时3种难溶电解质的溶度积:AgCl??? 1.8×10-10 ;AgI?? 1.5×10-16 ;Mg(OH)2???1.8×10-11 。在25℃上述3种难溶电解质各自的饱和溶液中,下列判断正确的是[???? ]
A.AgCl饱和溶液中c(Ag+)比AgI饱和溶液中c(Ag+)大
B.AgCl饱和溶液中c(Ag+)比Mg(OH)2 饱和溶液中c(Mg2+)大
C.将AgCl与AgI的饱和溶液等体积混合,再加入足量浓AgNO3溶液,则发生的反应为:AgCl与AgI沉淀都有,但以AgI沉淀为主。
D.若往AgCl饱和溶液中加入0.1 mol/LKI溶液,有黄色沉淀产生
参考答案:AD
本题解析:
本题难度:一般
4、选择题 常温下,AgCl、AgBr、AgI的溶度积常数(Ksp)依次为1.8×10-10、5.0×10-13、8.3×10-17。下列有关说法错误的是( )
A.常温下在水中的溶解能力:AgCl>AgBr>AgI
B.在AgCl饱和溶液中加入足量浓NaBr溶液有AgBr沉淀生成
C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCl沉淀生成
D.在AgI饱和溶液中加入NaI固体有AgI沉淀析出
参考答案:C
本题解析:
试题分析:根据三种物质的溶度积常数大小可知,氯化银的溶解度最大,A正确;根据沉淀容易向溶解度更小的方向进行可知,B正确;C不正确,因为只要溶液中氯离子和银离子的浓度之积对于溶度积常数即可析出氯化银沉淀;增大碘离子的浓度,溶解平衡向沉淀析出的方向移动,D正确,答案选C。
点评:该题是高考中的促进题型,属于中等难度的试题,试题基础性强,难易适中。侧重考查学生对溶解平衡的了解、掌握程度,有利于培养学生的逻辑推理能力和灵活应变能力。
本题难度:一般
5、选择题 要使工业废水中的Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下,由以下数据可知,沉淀剂最好选用
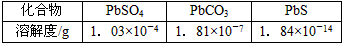 [???? ] [???? ]
A.硫化物
B.硫酸盐
C.碳酸盐
D.以上沉淀剂均可
参考答案:A
本题解析:
本题难度:简单
|