微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应中,属于氧化还原反应的是
A.CuO+H2SO4= CuSO4+H2O
B.FeC13+3NaOH=Fe(OH)3↓+3NaCl
C.Fe+2FeC13=3FeC12
D.2Al(OH)3 A12O3+3H2O
A12O3+3H2O
参考答案:C
本题解析:凡是有元素化合价升降的反应都是氧化还原反应,所以选项C正确,其余都不是氧化还原反应,答案选C。
本题难度:一般
2、填空题 (共5分)在反应3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O中:
(1)_________元素化合价升高,_________元素化合价降低。(填元素名称)
(2)_________是氧化剂,Cu发生了_________反应,_________是氧化产物。
参考答案: 本题解析:略
本题解析:略
本题难度:简单
3、填空题 在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)稀释后的溶液pH= ;
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
参考答案:(1)0 &#
本题解析:
试题分析:(1)因为铜全部溶解,因此溶液中铜离子的物质的量为0.1 mol,那么与铜离子相结合的硝酸根离子的物质的量为0.2 mol。又因为溶液中总的硝酸根离子的物质的量为0.3 mol,所以以硝酸形式存在的离子的物质的量为0.1 mol,也可以理解为溶液中剩余硝酸的物质的量为0.1 mol,那么硝酸的浓度为1mol·L-1,所以其pH=0。(2)若a=9,则题中所提供的硝酸总的物质的量为0.45 mol,减去剩余的0.3mol,那么被还原的硝酸的物质的量为0.15 mol。因为这是一个氧化还原反应,氧化剂所得到的电子与还原剂所失去的电子的物质的量相等,还原剂铜所失去的电子一定为0.2mol,假设反应中生成的二氧化氮的物质的量为x mol, 那么一氧化氮的物质的量就为:(0.15-x)mol,如是有如下关系:
0.2=(0.15-x)×3+x,解之得:x="0.125" mol
考点:考查电子守恒。
本题难度:一般
4、选择题 化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,正确的是
A.BaSO4悬浊液中存在平衡:BaSO4(aq)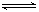 Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
B.向K2Cr2O7溶液中加入少量NaOH浓溶液,溶液由橙色变为黄色:Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓
D.铝热反应的原理为:Al2O3+2Fe 2Al+Fe2O3
2Al+Fe2O3
参考答案:B
本题解析:
试题分析:A、BaSO4悬浊液中存在平衡:BaSO4(s)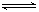 Ba2+(aq)+SO42-(aq),错误;B、在潮湿的空气中,生铁中含有碳容易发生电化学腐蚀,错误;C、漏掉了NH4+ 与OH-的反应,错误;D、铝热反应指的是铝和金属氧化物的反应,错误。
Ba2+(aq)+SO42-(aq),错误;B、在潮湿的空气中,生铁中含有碳容易发生电化学腐蚀,错误;C、漏掉了NH4+ 与OH-的反应,错误;D、铝热反应指的是铝和金属氧化物的反应,错误。
本题难度:简单
5、选择题 某温度下,将Cl2通入氢氧化钾溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比是1∶2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
A.2∶3
B.4∶3
C.10∶3
D.11∶3
参考答案:D
本题解析:
试题分析:Cl2的氯元素由0价变为-1价(即Cl-)是发生还原反应,被还原,Cl2的氯元素由0价变为+5价(即ClO3-)是发生氧化反应,被氧化, Cl2的氯元素由0价变为+1价(即ClO-)是发生氧化反应,被氧化,根据题目,经测定ClO-与ClO3-的物质的量之比是1∶2,设ClO-为Xmol,则ClO3-为2XmoL, 该过程失电子总数为11X,根据氧化还原反应中得失电子数相等的原则,可知得电子总数为11X, 根据分析,被还原的氯元素的量为11x,而被氧化的氯元素的量为3X ,所以二者之比为11X:3X=11:3;选D。
考点:考查氧化还原反应的计算。
本题难度:一般