微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
A.若PH>7,则一定是C1V1=C2V2
B.在任何情况下都是C(Na+)+C(H+)=C(CH3COO-) +C(OH-)
C.当PH=7时,若V1=V2,一定是C2>C1
D.若V1=V2,C1=C2,则C(CH3COO-) +C(CH3COOH)=C(Na+)
参考答案:A
本题解析:
试题分析:若二者恰好中和,溶液呈碱性,若氢氧化钠过量,溶液仍呈碱性,A错误;无论溶液显何性,都有电荷守恒:c(Na+)+c(H+)=c(CH3COO-) +c(OH-),B正确;若PH=7,则一定醋酸过量,C正确;若V1=V2,c1=c2,即氢氧化钠与醋酸恰好中和生成醋酸钠,c(CH3COO-) +c(CH3COOH)=c(Na+)为物料守恒式,D正确。
点评:掌握酸碱混合后溶液酸碱性判断的方法。
本题难度:一般
2、填空题 (10分)运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则由水电离产生的总c(OH-)=???????????;用离子方程式表示FeCl3溶液用于净水的原因??????????????????????????????????????????????????。
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-。
在NaHSO4溶液中c(H+)??????????c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH?????????7。
(3)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为????????????????????????????????。(已知Ksp(BaSO4)=1.1×10-10)
(4)写出下列反应的化学方程式:
苯的硝化反应 ???????????????????????。 乙醇的催化氧化反应????????????????。
参考答案:(10分)
(1)10-2mol/L (1分)???
本题解析:
试题分析:(1)FeCl3是强酸弱碱盐,溶于水发生水解成酸性,即Fe3++3H2O Fe(OH)3(胶体)+3H+,H+全部是由水电离生成的,pH=2,c(H+)=10-2mol/L,c(OH-)水= c(H+)水=10-2mol/L。胶体能吸附离子,达到净水的目的。(2)在NaHSO4溶液中的H+来自水
Fe(OH)3(胶体)+3H+,H+全部是由水电离生成的,pH=2,c(H+)=10-2mol/L,c(OH-)水= c(H+)水=10-2mol/L。胶体能吸附离子,达到净水的目的。(2)在NaHSO4溶液中的H+来自水
本题难度:一般
3、填空题 (7分)
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为???????(填序号)。
A.9
B.13
C.11~13之间
D.9~11之间
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)
????????????????????????c(CH3COO-)(填“>”、“=”或“<”)。
(3)常温下,已知某NH4Cl溶液中的c(NH4+)=c(Cl一),则该溶液的pH???7(填“>”、“=”或“<”)。
(4)如果将HCl和CH3COONa溶液等浓度、等体积混合,则混合溶液中各离子浓度的大小关系为????????????????????????????
参考答案:
(1)D (1分)?????(2)< (2分)
本题解析:略
本题难度:简单
4、选择题 己知:HCN(aq)与NaOH(aq)反应的△H="-12.1" kJ/mol;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ/mol。则HCN在水溶液中电离的△H等于( )
A.-67.7 kJ/mol
B.-43.5 kJ/mol
C.+43.5 kJ/mol
D.+67.7 kJ/mol
参考答案:C
本题解析:根据能量守恒定律可知,HCN在水溶液中电离的△H=-12.1 kJ/mol+55.6kJ/mol=+43.5 kJ/mol,答案选C。
本题难度:一般
5、判断题 在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
加入盐酸体积V/Ml
| 2
| 4
| 6
| 8
| 10
| 12
| 14
| 16
| 18
| 20
|
测得溶液温度t/ ℃
| 15.2
| 19.6
| 22.0
| 26.0
| 28.2
| 26.7
| 25.7
| 24.7
| 23.7
| 22.9
(1)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线。
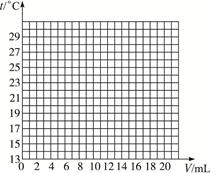
(2)根据曲线讨论溶液温度变化的原因。
①加入盐酸的量在2—10 mL之间时:_____________________________________________;
②加入盐酸的量在10—20 mL之间时:____________________________________________。
(3)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答:__________________________________________________________________________。
参考答案:(1)
 本题解析:用描点法将表格中的数据在图上表示出来,再连接成曲线。根据图象发现盐酸的量在2—10 mL时,随盐酸量增加,中和反应放出热量增大,溶液温度上升;当盐酸的量在10—20 mL之间,可能是盐酸已经过量,过量盐酸起冷却降温作用。不能用氢氧化钠固体,因为它在溶解过程中也会放热。 本题解析:用描点法将表格中的数据在图上表示出来,再连接成曲线。根据图象发现盐酸的量在2—10 mL时,随盐酸量增加,中和反应放出热量增大,溶液温度上升;当盐酸的量在10—20 mL之间,可能是盐酸已经过量,过量盐酸起冷却降温作用。不能用氢氧化钠固体,因为它在溶解过程中也会放热。
本题难度:简单
|