微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
 Ca5(PO4)3OH(固)
Ca5(PO4)3OH(固) 5Ca2++3PO43-+OH-
5Ca2++3PO43-+OH-
(1)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿受腐蚀,其原因是?????????。(3分)
(2)已知Ca(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固。请用离子方程式表示:????????????????????????????????????????????????????(3分)
(3)当牙膏中配有氟化物添加剂后能防止龋牙的原因?????????????????????????。(3分)
(4)根据以上原理,请你提出一种其他促进矿化的办法:????????????????????????。(3分)
参考答案:(1)生成的有机酸,中和OH-,使平衡向脱矿方向移动,加速牙
本题解析:进食后,细菌和酶作用于食物,产生有机酸,使得Ca5(PO4)3OH固体减小,牙齿受到腐蚀。使用氟化物,增大了F-的浓度,促进了Ca(PO4)3F的生成。促进矿化要使平衡向逆反应方向移动,可以增加生成物的浓度。
本题难度:一般
2、选择题 关节炎病原因是在关节滑液中形成尿酸钠晶体:HUr(尿酸)+H2O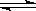 Ur﹣(尿酸根离子)+H3O+? Ur﹣(溶液)+Na+(溶液)
Ur﹣(尿酸根离子)+H3O+? Ur﹣(溶液)+Na+(溶液)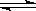 NaUr(固)
NaUr(固)
第一次关节炎发作大部分在寒冷季节脚趾和手指的关节处。下列叙述不正确的是
A?尿酸酸性比盐酸弱????????????????? B?尿酸钠的溶解度随温度升高而增大
C?反应①为吸热反应,②为放热反应??? D?尿酸钠的熔点很低。
参考答案:D
本题解析:根据反应式可知,尿酸存在电离平衡,电离是吸热的,属于弱酸,A、C正确。节炎发作大部分在寒冷季节,说明尿酸钠熔点比较高,所以选项D是错误的。答案选D。
本题难度:一般
3、选择题 在某容积不变的密闭容器中放入一定量的NO2,发生反应2NO2(g)  N2O4(g);ΔH<0,在达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使平衡混合气体平均相对分子质量减小的是??? ( )
N2O4(g);ΔH<0,在达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使平衡混合气体平均相对分子质量减小的是??? ( )
A.通入N2
B.通入NO2
C.通入N2O4
D.降低温度
参考答案:A
本题解析:容器容积不变,通入氮气,平衡不移动。但由于氮气的相对分子质量小于NO2和N2O4的,所以混合气体平均相对分子质量减小;由于反应物和生成物都只有一种,因此不论再加入NO2还是N2O4,都相当于是增大压强,平衡向正反应方向移动,混合气体平均相对分子质量增大;正反应是放热反应,降低温度平衡向正反应方向移动,混合气体平均相对分子质量增大,答案选A。
本题难度:一般
4、填空题 常温下,两种溶液① 0.1 mol?L-1 NH3·H2O?????② 0.1 mol?L-1 NH4Cl中:
(1)溶液①的pH ?????7(填“>”、“<”或“=”),其原因是:???????????????????????(用电离方程式表示)。
(2)溶液②呈?????性(填“酸”、“碱”或“中”)。水解反应是吸热反应,升温可以?????????????????(填“促进”或“抑制”)NH4Cl的水解。
(3)下列关于两种溶液中c(NH4+) 的叙述正确的是???????(填字母)。
a.两种溶液中c(NH4+) 都等于0.1 mol?L-1
b.两种溶液中c(NH4+) 都小于0.1 mol?L-1
c.NH4Cl溶液中c(NH4+) 小于NH3·H2O溶液中c(NH4+)
参考答案:(1)>(1分)?? NH3·H2O  本题解析:
本题解析:
试题解析:(1)NH3·H2O是弱碱,其在水中部分电离产生NH4+、OH-,所以pH>7,
(2)NH4Cl溶液中的NH4+水解会使溶液呈酸性,pH<7,水解反应是吸热反应,升温使平衡向吸热反应方向进行,因此会促进NH4Cl的水解。
(3)a、NH3·H2O是弱碱,不完全电离;NH4Cl溶液中NH4+部分水解,所以两种溶液NH4+的浓度均小于0.1mol/l,错误;b、正确;c、两种溶液中NH4+的浓度的大小由电离程度和水解程度的强弱来判断,本题中无法判断,答案选b。
本题难度:简单
5、选择题 在一定温度下可逆反应N2+3H2 2NH3已达到平衡,下列有关说法正确的?? (??? )
2NH3已达到平衡,下列有关说法正确的?? (??? )
①1个N≡N键断裂的同时,有3个H—H键形成
②反应混合物中各组分的体积分数保持不变
③恒温恒容时,容器内的压强不再改变
④1个N≡N键断裂的同时,有3个N—H 键形成
⑤NH3生成的速率与NH3分解的速率相等
⑥单位时间生成n molN2,同时生成2n molNH3
⑦气体的平均相对分子质量不再改变
⑧N2?H2?NH3的分子数一定为1∶3∶2
⑨恒温恒容时,气体的总物质的量不再改变
⑩恒温恒压时,容器内的密度不再改变
A.①②③④⑤⑥⑦⑨
B.①②③⑤⑥⑩
C.③④⑤⑥⑦⑧
D.①②③⑤⑥⑦⑨⑩
参考答案:D
本题解析:
试题分析:① 1个N≡N键断裂的同时,有3个H—H键断裂,若形成3个H—H键。单位时间内H—H键断裂的个数与形成的个数相等。证明达到平衡。②反应达到平衡时各物质的物质的量不变,反应混合物中各组分的物质的量也不变,所以体积分数保持不变。正确。③恒温恒容时,反应达到平衡时个种气体的物质的量不变,总物质的量也不变,所以容器内的压强不再改变。正确。④ 在任何时刻每有1个N≡N键断裂的同时,就有3个N—H 键形成,这是反应向正反应方向进行,不能说明反应达到平衡。错误。⑤ NH3生成的速率与NH3分解的速率相等,则氨气的浓度不变,反应达到平衡。正确。⑥单位时间生成n molN2,必然消耗2nmol NH3。同时生成2n molNH3。则NH3的浓度不变,达到平衡。正确。⑦反应符合质量守恒定律。如果气体气体的平均相对分子质量不再改变,说明气体的物质的量不变,即反应达到平衡。正确。⑧N2?H2?NH3的分子数一定为1∶3∶2 只是反应过程中的一个非常特殊的情况,可能达到平衡,一可能没达到平衡。错误。⑨该反应是个反应前后气体体积不等的反应,若恒温恒容时,气体的总物质的量不再改变,即各物质消耗的浓度与生成的浓度相等,反应达到平衡。正确。⑩恒温恒压时,容器内的密度不再改变 也就是气体的物质的量不变。该反应是反应前后气体体积不等的反应,若气体的物质的量不变,则反应达到平衡。正确。正确的说法是①②③⑤⑥⑦⑨⑩。选项为:D。
本题难度:一般