0.120
(1)该反应的平衡常数表达式为______________________;
从表中分析:c1________c2;c3________c4(填“>”、“<”或“=”)。
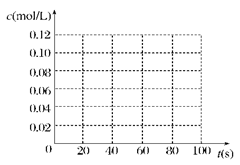
(2)在下图中画出并标明此反应中c(N2O4)和c(NO2)的浓度随时间变化的曲线。
(3)在上述条件下,从反应开始直至达到化学平衡时,四氧化二氮的平均反应速率为__????????mol/(L·s)。
(4)反应达到平衡后,下列条件的改变可使NO2气体的浓度增大的是?? ??
A.增大容器的容积 ???????????????????????????? B.再充入一定量的N2O4
C.分离出一定量的NO2????????????????????????????? D.再充入一定量的He
参考答案:(13分) (1)K= 本题解析:】(1)N2O4???? 本题解析:】(1)N2O4???? ????2NO2 ????2NO2
初n:???????? 0.10??????????? 0
20s:???????? 0.07?????????? 0.06
40s????????? 0.05?????????? 0.10
60s:???????? 0.04?????????? 0.12
80s:???????? 0.04??????????? 0.12
(3)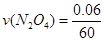 =0.001 mol/(L·s) =0.001 mol/(L·s)
(4)增大容器的容积,各物质浓度均减少,虽然平衡略向右移,但NO2气体的浓度相对原平衡仍然是减小;而在题设条件下,恒容,分离出一定量的NO2,其浓度减少,虽然平衡略向右移,但NO2气体的浓度相对原平衡仍然是减小;再充入一定量的He,各物质浓度不变,平衡不移动;再充入一定量的N2O4,平衡正向移动,NO2气体的浓度增大,符合题意。
本题难度:一般
2、选择题 已知反应I2(g)+H2(g)  2HI(g)? ΔH<0,下列说法正确的是( ) 2HI(g)? ΔH<0,下列说法正确的是( )
A.降低温度,正向反应速率减小倍数大于逆向反应速率减小倍数
B.升高温度将缩短达到平衡的时间
C.达到平衡后,保持温度和容积不变,充入氩气,正、逆反应速率同等倍数增大
D.达到平衡后,保持温度和压强不变,充入氩气,HI的质量将减小
参考答案:B
本题解析:
试题分析:根据方程式可知,该反应是体积不变的放热的可逆反应,降低温度,正向反应速率减小倍数小于逆向反应速率减小倍数,平衡向正反应方向移动,A不正确;升高温度,反应速率增大,将缩短达到平衡的时间,B正确;达到平衡后,保持温度和容积不变,充入氩气,浓度不变,正、逆反应速率均不变,平衡不移动,C不正确;达到平衡后,保持温度和压强不变,充入氩气,容器的容积必然增大,但平衡不移动,HI的质量不变,D不正确,答案选B。
点评:该题是中等难度的试题,试题贴近高考,针对性强,有利于培养学生的逻辑推理能力和发散思维能力。该题的易错点是选项CD,注意压强对反应速率和平衡状态影响的实质。
本题难度:简单
3、选择题 下列事实不能用勒沙特列原理解释的是
A.往H2S溶液中加碱,有利于S2-增多
B.500℃左右比室温更利于氨的合成
C.使用V2O5作催化剂可加快SO2转化为SO3的速率
D.醋酸溶液与锌反应放出H2,加入适量醋酸钠晶体可以减慢放出H2的速率
参考答案:BC
本题解析:
【错解分析】漏选B或C
【正解】勒沙特列原理又称化学平衡移动原理,其研究对象是平衡移动,因此只要涉及平衡移动即可解释。选项C的叙述完全正确,但是它是针对反应速率而言、与该原理毫无关系,不应漏选。选项B中的温度与上一题有类似情况,它受反应速率、催化剂工作温度和平衡移动有关,恰好温度影响又不利平衡移动,因此也不能用勒沙特列原理解释。
本题难度:简单
4、填空题 (10分))对于A+2B(气) nC(气)在一定条件下达到平衡后,改变下列条件,请回答: nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增加或减少,平衡不移动,则A为______态。
(2)增压,平衡不移动,当n=2时,A的状态为________;当n=3时,A的状态为______。
(3)若A为固体,增大压强,C的组分含量减少,则____。
(4)升温,平衡向右移动,则该反应的逆反应为________反应。
参考答案:(1)固或液 ?? (2)固或液 ???气 ???? (3)
本题解析:考查外界条件对化学平衡的影响。
(1)A量的增加或减少,平衡不移动,则A一定是固态或液态。
(2)增压,平衡不移动,说明反应前后体积是不变的。当n=2时,A的状态一定是固态或液态。
(3)若A为固体,增大压强,C的组分含量减少,说明增大压强,平衡向逆反应方向进行,因此n≥3。
(4)升温,平衡向右移动,则正反应一定是吸热反应,所以逆反应就一定是放热反应。
本题难度:一般
5、选择题 下列事实中,不能用勒沙特列原理解释的是(????)
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
参考答案:B?
本题解析:勒沙特列原理适用于化学平衡。
本题难度:一般
|