微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 100g碳燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且C(s)+ 1/2O2(g) CO(g)? ΔH=-110.35kJ·mol-1,CO(g)+ 1/2O2(g)
CO(g)? ΔH=-110.35kJ·mol-1,CO(g)+ 1/2O2(g) CO2(g)? ΔH=-282.57kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是(???)
CO2(g)? ΔH=-282.57kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是(???)
A.392.92kJ
B.2489.44kJ
C.784.92kJ
D.3274.3kJ
参考答案:C
本题解析:100g碳燃烧所得气体中CO的物质的量为 ,这些物质的量CO完全燃烧放出的能量为
,这些物质的量CO完全燃烧放出的能量为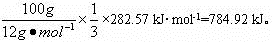
本题难度:一般
2、选择题 下列关于化学反应的认识错误的是[???? ]
A.会引起化学键的变化 ??
B.会产生新的物质 ??
C.必然引起物质状态的变化 ??
D.必然伴随着能量的变化
参考答案:C
本题解析:
本题难度:简单
3、填空题 (10分,每空2分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,将这二种物质混合时可发生如下反应:N2H4+2 H2O2 N2+4H2O,已知0.4 mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量。
N2+4H2O,已知0.4 mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量。
(1)反应的热化学方程式为_________________________________________________。
(2)又已知:H2O(l) H2O(g);ΔH="+44" kJ/mol。则16 g液态肼和足量的液态双氧水反应生成液态水时放出的热量是_______________kJ。
H2O(g);ΔH="+44" kJ/mol。则16 g液态肼和足量的液态双氧水反应生成液态水时放出的热量是_______________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有很大的优点是
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计
成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为
参考答案:(1)N2H4(l)+2 H2O2(l) 本题解析:
本题解析:
试题分析:N2H4+2 H2O2==N2+4H2O,已知0.4 mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量,反应的热化学方程式为)N2H4(l)+2 H2O2(l)="=" N2(g)+4H2O(g) △H=- 641.5 kJ/mol;又已知:H2O(l) H2O(g);ΔH="+44" kJ/mol,则16 g液态肼和足量的液态双氧水反应生成液态水时放出的热量=320.75 kJ +44 kJ/mol×2mol=408.75kJ;此反应用于火箭推进,除释放大量热和快速产生大量气体外产物为水和氮气不会造成环境污染;由题意可得:能构成原电池的反应:①是氧化还原反应,②是放热反应,故正确的为C项;反应原理为2H2(g)+O2(g)=2H2O(1) △H<0,则负极为H2放电:H2+2OH--2e- = 2H2O。
H2O(g);ΔH="+44" kJ/mol,则16 g液态肼和足量的液态双氧水反应生成液态水时放出的热量=320.75 kJ +44 kJ/mol×2mol=408.75kJ;此反应用于火箭推进,除释放大量热和快速产生大量气体外产物为水和氮气不会造成环境污染;由题意可得:能构成原电池的反应:①是氧化还原反应,②是放热反应,故正确的为C项;反应原理为2H2(g)+O2(g)=2H2O(1) △H<0,则负极为H2放电:H2+2OH--2e- = 2H2O。
考点:化学反应能量变化、电化学。
本题难度:困难
4、填空题 用下列:①H2O?②H2O2?③Ba(OH)2?④Na2O2?⑤Cl2?⑥Ar??⑦CO2?等物质填空。(填序号)
(1) 由离子键和非极性键构成的是 ?
(2) 由极性键和非极性键构成的是
(3) 不存在化学键的是????????
(4) 共价化合物有
(5) 含有极性共价键的离子化合物的是??????????
参考答案:(7分)(1)④,(2)② ,(3)⑥ ,(4)①②⑦,⑸
本题解析:
试题分析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间形成共价键。含有离子键的化合物就是离子化合物,全部由共价键形成的化合物是共价化合物。 根据以上信息解答。
点评:本题主要考查了化学键的判断、化学键和化合物的关系,题目难度不大,考查学生对基础知识的掌握程度。
本题难度:简单
5、选择题 决定化学反应速率的主要因素是
① 温度 ② 压强 ③ 催化剂 ④ 浓度 ⑤ 反应物本身的性质
A.①②③④⑤
B.⑤
C.①④
D.①②③④
参考答案:B
本题解析:反应物本身的性质是决定化学反应速率的主要因素,其他因素都是外界条件,所以答案是B。
本题难度:困难