微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g) 2NH3(g)?△H=" —92.4" kJ·mol-1,下列结论正确的是?????????????????????????????????????????????
2NH3(g)?△H=" —92.4" kJ·mol-1,下列结论正确的是?????????????????????????????????????????????
A.该反应达到平衡时,放出的热量等于92.4kJ
B.达到平衡后向容器中通入1mol氦气,平衡不移动
C.降低温度和缩小容器体积均可使该反应的平衡常数增大
D.若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90%
参考答案:BD
本题解析:由热化学方程式的意义可知,1mol N2(g)与3mol H2(g)完全反应,生成2mol NH3(g)时放出92.4kJ热量,但是合成氨是可逆反应,正反应不能进行到底,参加反应的物质不能完全消耗,放出的热量小于92.4kJ,故A错误;氦气是惰性气体,不能改变各组分的浓度,虽然能增大压强,但是平衡不能移动,故B正确;正反应是气态物质体积减小的放热反应,则降低温度能使平衡右移,平衡常数增大,而缩小容器体积就是增大压强,虽然平衡也右移,但是平衡常数不变,因为平衡常数只与温度有关,温度不变平衡常数不变,故C错误
本题难度:简单
2、填空题 化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化
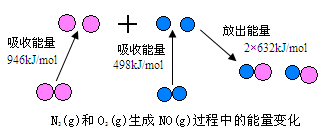
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为___________ kJ/mol,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式_______________________
(2)根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H。
C(石墨) + O2(g) = CO2(g);△H1 =" -" 393.5 kJ/mol
2H2(g) + O2(g) = 2H2O(l);△H2 =" -" 571.6 kJ/mol
2C2H2(g) + 5 O2(g) = 4CO2(g) + 2H2O(l);△H3 =" -" 2599.2 kJ/mol,
则由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H _______________________ kJ/mol。
参考答案:(1)946kJ/mol; N2(g) + O2(g)=2N
本题解析:
试题分析:(1)根据图中的数据可知,N≡N的键能为946kJ/mol。反应热是断键吸收的能量和形成化学键所放出的能量的差值,则该反应的反应热△H=946kJ/mol+498kJ/mol-2×632kJ/mol=-220kJ/mol,则该反应的热化学方程式是N2(g) + O2(g)=2NO(g) △H=-220kJ/mol。
(2)根据盖斯定律可知,(①×4+②-③)÷2即得到2C(石墨)+ H2(g)=C2H2(g),所以该反应的反应热△H=(-393.5 kJ/mol×4-571.6 kJ/mol+2599.2 kJ/mol)÷2==+226.8kJ/mol。
考点:考查反应热的计算和热化学方程式的书写
点评:该题是高考中的常见题型,属于中等难度试题的考查,试题综合性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和逆向思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是利用好盖斯定律。
本题难度:一般
3、选择题 根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=
参考答案:
本题解析:
本题难度:一般
4、选择题 已知反应X+Y=M+N 为放热反应,对该反应的下列说法中正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因该反应为放热反应,故不必加热就可发生
参考答案:C
本题解析:
试题分析:对于放热反应,从能量的角度来理解应该是:反应物的总能量一定比生成物的总能量要高,因此选C。放热反应有时也需要加热来引发反应,比如碳的燃烧。
考点:考查常识。
本题难度:一般
5、填空题 (4分)某些共价键的键能数据如下(单位:kJ/mol)
共价键
| H-H
| Cl-Cl
| Br-Br
| H-Cl
| H-I
| I-I
| N≡N
| H-O
| H-N
|
键?能
| 436
| 247
| 193
| 431
| 299
| 151
| 946
| 463
| 391
(1)把1molCl2分解为气态原子时,需要 (填“吸收”或“放出”) kJ能量。
(2)试通过键能数据估算H2(g)+Cl2(g)=2HCl(g)反应中的能量变化:(填“吸收”或“放出”)????????????? kJ能量。
参考答案:(1)吸收;247?(2)放出179
本题解析:(1)断键是吸热的,根据键能可知,把1molCl2分解为气态原子时,需要247kJ的能量。
(2)反应热就是断键吸收的总能量和形成化学键所放出的总能量的差值,即436 kJ/mol+247 kJ/mol-2×431 kJ/mol=-179 kJ/mol,即是放热反应。
本题难度:一般
|