微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 碘与氢气反应的热化学方程式为:
①I2(g)+H2(g)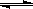 2HI(g) ΔH=" -" 9.48 kJ·mol-1
2HI(g) ΔH=" -" 9.48 kJ·mol-1
②I2(s)+H2(g)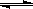 2HI(g) ΔH=" +" 26.48 kJ·mol-1,由此判断下列说法或反应正确的是
2HI(g) ΔH=" +" 26.48 kJ·mol-1,由此判断下列说法或反应正确的是
A.反应①的产物比反应②的产物稳定
B.I2(s)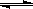 I2(g)ΔH=" +" 17.00 kJ·mol-1
I2(g)ΔH=" +" 17.00 kJ·mol-1
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol I2(g)中通入1 mol H2(g),反应后放热9.48 kJ
参考答案:C
本题解析:
试题分析:A、同一种物质在相同条件下,能量一样多,A错误;B、利用盖斯定律可得出1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ,B错误,C项正确;D、反应是可逆反应,反应物不能完全转化,放热达不到9.48 kJ,D错误。答案选C。
考点:考查化学反应热的计算。
本题难度:一般
2、选择题 研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量的变化。据此判断以下叙述中错误的是 [???? ]
A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低 ??
B.物质燃烧可看成是储存在物质内部的能量(化学能)转化为热能释放出来 ??
C.氮气分子内部存在着很强的化学键,故通常情况下氮气的化学性质很活泼 ??
D.需要加热才能发生的反应不一定是吸收热量的反应
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列变化过程中,需要吸热的是( )
A.生石灰与水混合
B.天然气燃烧
C.浓硫酸溶于水
D.干冰气化
参考答案:D
本题解析:
试题分析:A、B、C都是放热的,干冰气化需要吸热,答案选D。
考点:考查变化过程中的能量变化
点评:需要吸热或放热的过程不一定是吸热反应或放热反应,因为只有在化学反应中才能分放热反应或吸热反应。
本题难度:一般
4、选择题 下列化学键中,都属于极性共价键的是(???)
A.共价化合物中的化学键
B.离子化合物中的共价键
C.同种元素原子间的共价键
D.不同元素原子间的共价键
参考答案:D
本题解析:
试题分析:极性共价键是指共用电子对偏移的共价键,由不同元素的原子形成。所以D正确;共价化合物中的化学键属于极性共价键或非极性共价键,所以A不符合;离子化合物中的共价键属于极性共价键或非极性共价键,所以B不符合;同种元素原子间的共价键属于非极性共价键,所以C不符合。故选D。
点评:本题考查共价化合物和离子化合物的比较,主要考查极性共价键的判断,难度中等。
本题难度:一般
5、填空题 (12分)氯化铍是用于制有机铍化合物和金属铍的重要原料。
(1)BeCl2分子中组成元素Be的基态原子的价电子排布式为????????,其元素的第一电离能???B元素(填“>”或“<” 或“=”),原因是??????????????????????????。
(2)已知BeCl2加热易升华,液态BeCl2不导电,BeCl2晶体类型为?????????????; BeCl2中Be原子的杂化轨道类型是???????????。
(3)用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子达到8电子稳定结构,则该离子内存在的微粒间的作用力是????????????,阴离子的结构式为?????????????。
参考答案:(1)2s2 (2分);??>?(1分);?? Be的
本题解析:(1)Be是第ⅡA元素,所以根据构造原理可知,Be原子的基态价电子排布式为2s2。非金属性越强,第一电离能越大,但由于Be的2s轨道全充满,稳定性强,体系能量低,所以第一电离能大于B的。
(2)根据BeCl2的物理性质可判断,形成的晶体应是分子晶体、BeCl2分子中心原子没有孤对电子,所以是直线型结构,采用sp杂化。
(3)阴离子内铍原子达到8电子稳定结构,说明分子内除了含有共价键以外,还一定存在配位键,即氯原子提供电子对,Be原子提供空轨道,结构式为 本题难度:一般
本题难度:一般