微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏伽德罗常数的值。下列叙述正确的是(??? )
A.20mL 10 mol/L浓硫酸或浓硝酸与足量铜加热反应转移电子数均为0.2NA
B.0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA
C.标准状况下,2.24LCl2通人足量H2O或NaOH溶液中转移的电子数均为0.1NA
D.在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA
参考答案:D
本题解析:
试题分析:A、浓硫酸与铜反应,当浓度变稀时,反应就停止,错;B、0.1mol的白磷(P4)中含有的共价键为0.6mol,B错;C、氯气与水的反应是可逆反应,不可能进行彻底,错。
本题难度:一般
2、选择题 下列溶液中Cl-的物质的量浓度最大的是
A.200mL 2.5mol/L MgCl2溶液
B.1000mL 4mol/L NaCl溶液
C.400mL 5mol/L KClO3溶液
D.250mL 2mol/L AlCl3溶液
参考答案:D
本题解析:
试题分析:A项中c(Cl-)为5mol/L,B项中c(Cl-)为4mol/L,C项中没有Cl-,A项中c(Cl-)为6mol/L,所以D中Cl-浓度最大,答案选D。
点评:本题注意KClO3中含有Cl原子而不含有Cl-。
本题难度:简单
3、选择题 若NA表示阿伏加德罗常数的值,下列说法正确的是
A.2 .24 L NH3溶干1 L水中得到OH-数约为0.1NA
B.l 4 g N2与CO的混合气体含有的原于数目为NA
C.25℃时pH=13的NaOH溶液中含有OH-的数目为0 .l NA
D.含l mol H2 SO4的浓硫酸与足量铜反应转移的电子为NA
参考答案:B
本题解析:
试题分析:A、未指明标准状况,所以2.24L的氨气的物质的量不是0.1mol,且氨气溶于水生成一水合氨是弱碱,不完全电离,无法判断OH-数,错误;B、氮气和CO的相对分子质量相同,所以14g的混合气体的物质的量是0.5mol,且二者都是双原子分子,所以混合气体中的原子数目是NA,正确;C、25℃时pH=13的NaOH溶液中含有OH-的浓度是0.1mol/L,但离子数目因未知溶液体积而无法确定,错误;D、浓硫酸与铜的反应中,随反应的进行,硫酸逐渐变稀,而稀硫酸与铜部分应,所以转移电子的数目小于NA,错误,答案选B。
考点:考查阿伏伽德罗常数的理解应用
本题难度:一般
4、选择题 设NA为阿伏加德罗常数,下列说法正确的是( )
A.常温常压下,0.2NA个NH3分子的质子数NA
B.1 mol NaCl中,所有Na+的最外层电子总数为8NA
C.7.1g Cl2变为氯离子时,得到的电子数一定为0.1NA
D.1L 0.2 mol/L硫酸铁溶液中含有的SO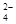 离子数目为0.2NA
离子数目为0.2NA
参考答案:D
本题解析:A错,常温常压下,0.2NA个NH3分子的质子数2NA;
B错,1 mol NaCl中,所有Na+的最外层电子总数为10NA;
C错,7.1g Cl2变为氯离子时,得到的电子数不一定为0.1NA,如铁与氯气反应生成FeCL3,得到的电子数为0.2NA;
D正确,1L 0.2 mol/L硫酸铁溶液中的SO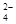 本题难度:简单
本题难度:简单
5、填空题 (1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________。
(3)A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断B可能是________。
参考答案:(1)64(2)30 g/mol?(3)H2
本题解析:
试题分析:(1)当摩尔质量以“g/mol”为单位时,其数值与该物质的相对分子质量数值相等。在标准状况下,672mL该气体的物质的量为n="v/22.4" L/mol=0.03mol,该气体的摩尔质量为M=m/n=64g/mol,该气体的相对分子质量为64.(2)由n=m/M知,等质量的物质其物质的量与摩尔质量成反比;根据阿伏加德罗定律,同温同压下,气体的体积之比等于物质的量之比;甲烷的摩尔质量16g/mol,CH4和A气体的物质的量之比是15∶8,所以A的摩尔质量为30 g/mol;(3)标准状况
本题难度:一般