微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 研究物质性质的基本程序是一个系统化的过程.下列各项中,属于研究物质性质一般程序的第二步的是
A.预测物质性质
B.观察物质的外观性质
C.进行实验和观察
D.做出有关解释和结论
参考答案:A
本题解析:分析:对物质性质进行研究的基本程序是:观察物质的外观性质→预测物质性质→设计实验→观察实验现象→对实验现象进行分析、解释→得出结论.
解答:对物质性质进行研究的基本程序是:观察物质的外观性质→预测物质性质→设计实验→观察实验现象→对实验现象进行分析、解释→得出结论,第二步是预测物质性质,故选A.
点评:本题考查研究物质性质的基本程序,熟记教材知识是关键,难度不大.
本题难度:一般
2、选择题 下列物质的性质,属于化学性质的是
A.在标准状况下,氧气的密度比空气略大
B.氧气难溶于水
C.绿色的碱式碳酸铜受热后变成黑色物质
D.镁带很容易被折弯
参考答案:C
本题解析:试题分析:本题是对物质性质的考查。属于基础性的题目,解题技巧在于掌握课本中所提到的物理性质和化学性质。
选项A、密度是一种物理性质;
选项B、溶于水,说的是溶解性,为物理性质;
选项C、受热分解,是一种化学性质,因为这一过程发生了化学变化;
选项D、被折弯,只是形态的改变,因此为物理性质
考点:物质的性质
点评:物理性质:指物质不需要发生化学变化就表现出来的性质。如颜色、状态、气味、熔沸点、密度、硬度、导电性、导热性、溶解性、挥发性、延展性、吸附性等;
化学性质:指物质在化学变化中表现出来的性质。如可燃性、助燃性、稳定性、氧化性、还原性、酸碱性、毒性等。
本题难度:困难
3、选择题 保持氧气化学性质的最小微粒是
A.氧原子
B.氧分子
C.氧离子
D.氧元素
参考答案:B
本题解析:试题分析:本题是对分子性质的考查。分子是保持物质化学性质的最小粒子,因此,保持氧气化学性质的最小微粒应该为氧气分子,故答案选B。
考点:分子的性质
点评:本题考查的是分子的性质,“分子式保持物质化学性质的最小粒子”;另外,对已原子的性质,也可以进行归纳对比,“在化学变化中,分子可分,而原子不能再分。”注意:对于原子不可再分,是特指在化学变化中不可再分;在物理变化中,原子是可以继续分的。
本题难度:简单
4、选择题 某NaOH溶液的溶质质量分数是10%,则此溶液中Na+与H2O的个数比为
A.1:10
B.1:20
C.1:11.5
D.1:23
参考答案:B
本题解析:分析:令溶液的质量为100g,则氢氧化钠的质量为10g,水的质量为100g-10g=90g,根据n= 计算氢氧化钠、水的物质的量,钠离子的物质的量等于氢氧化钠的物质的量,物质的量之比等于分子数之比,据此计算判断.
计算氢氧化钠、水的物质的量,钠离子的物质的量等于氢氧化钠的物质的量,物质的量之比等于分子数之比,据此计算判断.
解答:令溶液的质量为100g,则氢氧化钠的质量为10g,水的质量为100g-10g=90g.
10g氢氧化钠的物质的量为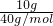 =0.25mol,所以钠离子的物质的量为0.25mol.
=0.25mol,所以钠离子的物质的量为0.25mol.
90g水的物质的量为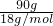 =5mol.
=5mol.
所以此溶液中Na+与H2O的个数比为0.25mol:5mol=1:20.
故选:B.
点评:考查常用化学计量的有关计算、质量分数,难度不大,关键清楚溶液的组成,注意基础知识的掌握.
本题难度:困难
5、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.在常温常压下,17?g硫化氢所含质子数目为8?NA
B.1molNa2O2溶于水时转移的电子数为2NA
C.一定温度下,1L0.5mol?L-1NH4Cl溶液与2L0.25mol?L-1NH4Cl溶液含NH4+物质的量不同
D.1mol?苯分子中含有碳碳双键数为3NA
参考答案:C
本题解析:分析:A.质量换算物质的量,结合质子数计算分析;
B.根据物质的量与转移电子之间的关系判断,1molNa2O2与水完全反应时转移电子数为NA;
C.NH4+发生水解,NH4+浓度越小水解程度越大,NH4+浓度越大,水解程度越小,所以溶液中NH4+数目取决于溶液体积与NH4+的浓度;
D.苯分子中的碳碳键是完全等同的特殊化学键,不是双键.
解答:A.在常温常压下,17?g硫化氢的物质的量为:n=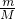 =
=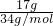 =0.5mol,1个氢原子含有1个质子,1个硫原子含有16个质子,所以1molH2S含有18mol质子,0.5mol硫化氢所含质子数目,9?NA,故A错误;
=0.5mol,1个氢原子含有1个质子,1个硫原子含有16个质子,所以1molH2S含有18mol质子,0.5mol硫化氢所含质子数目,9?NA,故A错误;
B.2Na2O2+2H2O=4NaOH+O2 ↑反应中O元素化合价由-1价降低为-2价,由-1升高为0价,Na2O2既是氧化剂又是还原剂,各占 ,1molNa2O2完全反应转移电子物质的量为1mol×2×
,1molNa2O2完全反应转移电子物质的量为1mol×2× =1mol,转移电子数目为:1mol×NAmol-1=1NA,故B错误;
=1mol,转移电子数目为:1mol×NAmol-1=1NA,故B错误;
C.NH4+发生水解,NH4+浓度越小水解程度越大,NH4+浓度越大,水解程度越小,所以溶液中NH4+数目前者大于后者,故C正确;
D.苯分子中的碳碳键是介于碳碳双键和碳碳单键之间的一种特殊的化学键,是完全等同的特殊化学键,不是双键,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的应用,掌握盐类水解的应用、氧化还原反应电子转移的计算、苯的结构等知识是解答的关键,题目难度不大.
本题难度:一般