微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:C(s)+H2O(g)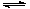 CO(g)+H2(g)?131.4 kJ。
CO(g)+H2(g)?131.4 kJ。
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5miin的平均反应速率为_________________________。
(2)能说明该反应已达到平衡状态的是________(选填编号)。
a.v正 (C)= v逆(H2O)???b.容器中CO的体积分数保持不变
c.c(H2)=c(CO)??????? d.炭的质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:
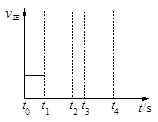
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2经如下两步反应制得甲酸甲酯:
①CO(g) + 2H2(g)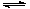 CH3OH(g)???②CO(g) + CH3OH(g)
CH3OH(g)???②CO(g) + CH3OH(g)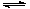 HCOOCH3(g)
HCOOCH3(g)
①反应①中CO的平衡转化率(α)与温度、压强的关系如图所示。在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是????????????????????????????????。
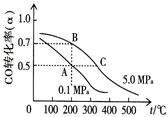
②已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则5.04kgCO最多可制得甲酸甲酯????????kg。
参考答案:(本题共10分)(1)0.002mol/(L·min)(2分
本题解析:
试题分析:(1)5min后容器内气体的密度增大了0.12g/L,因此气体的质量增加了0.12g/L×3L=0.36g,根据方程式可知:C(s)+H2O(g)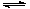 CO(g)+H2(g)?△m↑
CO(g)+H2(g)?△m↑
1mol???????????????????? 12g
0.03mol??????????????
本题难度:困难
2、填空题 汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: N2(g)+O2(g)?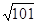 2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v(N2)正=v(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________(填字母序号)。
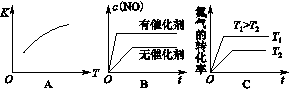
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应___________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____
参考答案:(1)0.05 mol/(L·min) (2)A、D (3)
本题解析:
试题分析:(1) V(N2)=ΔC(N2)÷Δt="(0.5mol÷2L)÷5min=0.05" mol/(L·min)。(2)A.根据反应方程式可知:消耗1 mol N2同时就消耗1 mol O2,还生成1 mol O2,则氧气的消耗速率与产生速率相等,反应达到平衡状态,正确;B.因为反应是在恒容条件下进行,反应前后气体的质量也不变,所以无论反应是否达到平衡,混合气体密度不变,因此不能作为判断平衡的标志,错误;C.因为气体的物质的量不变,质量也不变,所以混合气体平均相对分子质量不变不能作为判断平
本题难度:一般
3、选择题 一定温度下,反应N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的标志是( )
A.N2,H2和NH3的质量分数不再改变
B.c(N2):c(H2):c(NH3)=1:3:2
C.某时间内断裂3molH-H键的同时,形成6molN-H键
D.单位时间里每增加1molN2,同时减少2molNH3
参考答案:A、N2、H2和NH3的质量分数不再改变,说明达到平衡状态,
本题解析:
本题难度:简单
4、选择题 在一体积固定的密闭容器中充入一定量的SO2和O2,发生反应:2SO2+O2?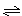 ???2SO3,已知V(SO2)==0.05mol·l-1·min-1,则2min后SO3的浓度为(???)
???2SO3,已知V(SO2)==0.05mol·l-1·min-1,则2min后SO3的浓度为(???)
A.1mol·l-1
B.0.1mol·l-1
C.0.9mol·l-1
D.0.2mol·l-1
参考答案:B
本题解析:反应速率通常用单位时间内浓度的变化量来表示,所以2min内SO2的浓度变化量是0.05mol·l-1·min-1×2min=0.1mol/L,根据方程式可知生成三氧化硫的浓度为0.1mol/L。答案选B。
本题难度:简单
5、选择题 甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l) HCOOH(aq)+CH3OH(aq) △H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
HCOOH(aq)+CH3OH(aq) △H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是

A.温度升高,该反应的平衡常数减小
B.0?10min,HCOOCH3的平均反应速率 u="0." 003mol·L-1 ? min-1
C.HCOOCH3平均反应速率先是增大,后减小,最后保持不变
D.80min时,反应刚达平衡,反应物转化率保持不变
参考答案:C
本题解析:
试题分析:甲酸甲酯的水解是吸热反应,升高温度平衡正向移动,平衡常数增大,A错;因题目中溶液体积V不确定,因此反应速率无法计算,B错。从甲酸甲酯转化率图像看,甲酸甲酯的转化率单位时间内先增大后减小,最终不变,因此反应速率先增大后减小,最终不变,C正确;75min时反应已经达到平衡,D错。
本题难度:一般