微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 把在空气中久置的铝片5.0 g 投入盛有500 mL 0.5 mol ·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
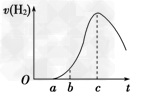
(1) 曲线由O →a段不产生氢气的原因是___________________________;有关反应的化学方程式为_________________ ;
(2) 曲线a→c段,产生氢气的速率增加较快的主要原因是____________________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是____________________________;
(4)该反应若使用催化剂,可使H2产量增多吗?______(填“会”或“不会”)。
参考答案:(1)硫酸首先和氧化铝反应,不产生H2;Al2O3+3H2S
本题解析:
本题难度:一般
2、填空题 反应:N2(g)+3H2(g) 2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
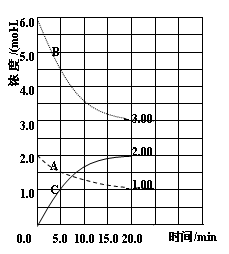
(1)图中B为 (填“N2”、“H2”或“NH3”)计算反应从开始→达平衡时H2的反应速率v(H2)=
(2)下图是在某温度下反应达到平衡,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示体系中各物质的浓度随时间变化的趋势(不需计算新平衡时的具体浓度,只要新平衡时浓度处于一个合理范围内即可。曲线上必须标出N2、H2、NH3)。
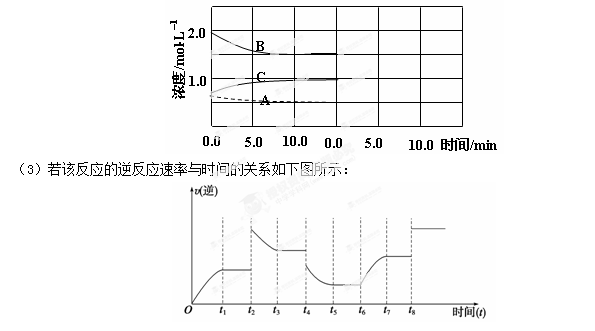
反应在t1、t3、t5、t7时都达到了平衡,而t2、t4、t6、t8时都改变了条件,试判断改变的条件是(填“升温”、“降压”……
参考答案:
本题解析:
本题难度:困难
3、填空题 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化亚铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0
①该反应的平衡常数表达式为:K=____________
②该温度下,在2L盛有粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为___________
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v) 和温度(T)的关系示意图中与铝热反应最接近的是_________
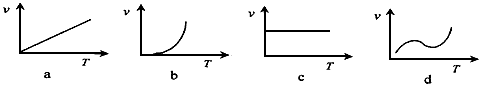
(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性。但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列方程式:?

(4)若将ag Fe和Al的混合物溶于2mol/L的足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为_________
参考答案:(1)①c3(CO2)/c3(CO);②0.015mol·L
本题解析:
本题难度:一般
4、选择题 常温下,下列溶液中各微粒浓度关系或pH判定不正确的是
A.将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2
B.某物质的溶液中由水电离的c(H+) = 1×10-a mol/L,若a>7,则pH一定为14-a
C.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:①>③>②
D.CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
参考答案:B
本题解析:
试题分析:A、反应中硫酸是过量的,所以反应后溶液中c(H+)=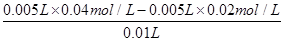 =0.01mol/L,则pH=2,A正确;
=0.01mol/L,则pH=2,A正确;
B、某物质的溶液中由水电离的c(H+)=1×10-a mol/L,若a>7,这说明该溶液中水的电离平衡是被破坏的。因此溶液可能显酸性,也可能显碱性,则pH不一定为14-a,也可能是a,B不正确
本题难度:简单
5、选择题 硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4==Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
[???? ]
????????? 反应温度/℃??????????? Na2S2O3溶液?????????????????? 稀H2SO4??????????????? H2O
????????????????????????????????? ? V/mL?????c/(mol·L-1)??????? V/mL????c/(mol·L-1)??????? V/mL?
A?????????? 25??????????????????? ?5???????????? 0.1???????????????? 10????????????0.1????????????????? 5
B???????????25???????????????????? 5?????????????0.2????????????????? 5?????????????0.2???????????????? 10
C?????????? 35??????????????????? ?5??????????? ?0.1?????????????????10??????????? 0.1????????????????? 5
D?????????? 35???????????????????? 5?????????????0.2????????????????? 5???????????? 0.2???????????????? 10
参考答案:D
本题解析:
本题难度:一般