微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为了除去MgCl2溶液中的FeCl3杂质,可在加热搅拌的条件下加入的一种试剂,然后过滤即可除去FeCl3杂质,该试剂是( )
A.NaOH
B.Na2CO3
C.氨水
D.MgCO3
参考答案:FeCl3易水解生成氢氧化铁,加入Mg(OH)2粉末、MgO
本题解析:
本题难度:一般
2、选择题 将等体积的苯、溴水和NaOH溶液在试管中充分混合后静置。下列图示现象正确的是[???? ]
A.
B.
C.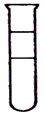
D.
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列除杂选用的试剂和方法不完全正确的是[???? ]
?
被提纯物质
杂质?
试剂
方法
A.
C2H6
C2H4
?溴水
洗气
B.
C2H4???
SO2
KMnO4溶液
洗气
C.
乙酸乙酯
?乙酸?
饱和Na2CO3溶液?
分液
D.
乙醇
水?
CaO
蒸馏
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列有关物质检验的实验结论正确的是
选项
| 实验操作及现象
| 实验结论
|
A
| 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
| 该溶液中一定含有SO42-
|
B
| 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色
| 该溶液中一定含有Fe2+
|
C
| 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊
| 该溶液中一定有CO32-
|
D
| 用洁净的铂丝蘸取某溶液,在无色火焰上灼烧,观察到火焰颜色为黄色
| 该溶液中一定含有Na+,可能含有K+
?
参考答案:BD
本题解析:
试题分析:A、向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,原溶液中可能含有Ag+、SO42-等,都可以生成白色沉淀,错误;B.向某溶液中加入2滴KSCN溶液,溶液不显红色,说明不含三价铁离子,再向溶液中加入几滴新制的氯水,溶液变为红色,说明生成了三价铁离子,证明溶液中一定含有亚铁离子,正确;C、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,溶液中可能含有碳酸根、碳酸氢根等,错误;D、用洁净的铂丝蘸取某溶液,在无色火焰上灼烧,观察到火焰颜色为黄色,该溶液中一定含有Na+,可能含有K+,正确。
本题难度:一般
5、实验题 髙纯氧化铁(a-Fe2O3)是现代电子工业重要材料。实验室用硫铁矿烧渣 (Fe2O3、FeO、SiO2等)为原料制备髙纯氧化铁的步骤如下。请回答有关问题:
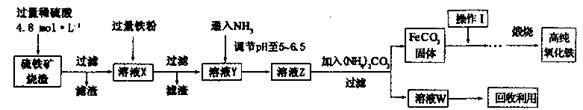
(1)过滤操作中的玻璃仪器为________。
(2)实验室需240mL4.8mol ? L-1的硫酸溶液,若用18.4 mol ? L-1的浓硫酸进行配制,所需要的最主要仪器为________。
(3)溶液X发生反应的离子方程式为________。
(4)简述如何检验溶液Z中的阴离子________。
(5)操作I的名称是________。列举W的一种用途________。
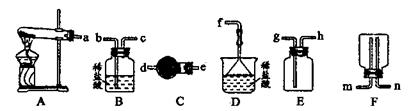
(6)??某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理,则接口的连接顺序是_______________。
(7)将多余的氨气分别通入水中或盐酸中,若得到25℃0.1 mol.L-1的NH3 ? H2O溶液或NH4Cl溶液,请你设计实验,比较NH3 ? H2O的电离程度和NH4Cl的水解程度大小。
参考答案:(每空2分,共14分)(1)漏斗、烧杯、玻璃棒(少一项扣1分
本题解析:
试题分析:(1)过滤操作中的仪器有铁架台(带铁圈)、漏斗、烧杯、玻璃棒,其中玻璃仪器是漏斗、烧杯、玻璃棒。
(2)由于没有250ml容量瓶,所以要配制240ml稀硫酸,所需要的最主要仪器为250ml容量瓶。
(3)由于溶液X中含有铁离子,因此加入铁粉发生反应的离子方程式为2Fe3++Fe=3Fe2+。
(4)根据流程图可知,溶液Y是氯化亚铁和硫酸的混合液。通入氨气后生成硫酸铵,因此溶液Z中含有SO42-。检验SO42-的操作是取少量溶液Z于试管中,然后加入稀盐酸,无沉淀产生,再加入BaCl2溶液,有白色沉淀产生,证明有SO42-。
(5)固体从溶液中过滤出来后,需要洗涤。因此操作I的名称是洗涤;溶液Z中加入碳酸铵后生成碳酸亚铁和硫酸铵,因此W是硫酸铵,其主要用途是用于化肥。
(6)根据装置图可知,A是发生装置。由于氨气密度小于空气且极易溶于水,所以用E装置收集氨气,D装置进行尾气吸收。由于生成的氨气中含有水蒸气,因此要干燥管高燥氨气,所以正确的连接顺序是a→e→d→h→g→f。
(7)要比较NH3 ? H2O的电离程度和NH4Cl的水解程度大小,可以通过测量等浓度、等体积的二者混合液的pH,或直接测量等浓度溶液的pH。即常温下,将等物质的量浓度(0.1mol/L)、等体积的氨水、NH4Cl溶液混合,若混合液pH>7,表明电离程度大于水解程度;否则电离程度小于水解程度。或用pH计分别测25℃时0.1mol/L氨气、NH4Cl溶液的pH,然后比较c(OH-)和c(H+),若c(OH-)>c(H+)表明电离程度大于水解程度;若c(OH-)<c(H+)表明电离程度小于水解程度。42-的检验;氨气制备、收集、除杂以及尾气处理;电离程度与水解程度比较等实验方案的设计等
本题难度:困难
|