微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 选择适当试剂和操作方法除去下列物质中的少量杂质(括号内为杂质)
(1)乙烷(乙烯),试剂_______________操作方法_________________________ _________________。
(2)苯(苯酚),试剂_________________操作方法__________________________________________。
参考答案:
(1)溴的四氯化碳溶液,洗气
(2)NaOH溶液
本题解析:
本题难度:一般
2、选择题 下表中除杂方法正确的是
选项
| 物质
| 所含杂质
| 除去杂质的方法
|
A.
| CO
| CO2
| 通过足量氢氧化钠溶液,并干燥
|
B.
| H2
| 水蒸气
| 通过盛有浓硫酸的洗气瓶
|
C.
| N2
| O2
| 通过炽热的木炭
|
D.
| NaOH溶液
| Na2CO3
| 加入足量稀盐酸至不再产生气泡
参考答案:AB
本题解析:正确答案:AB
A、正确;CO2+2NaOH=Na2CO3+H2O;B、正确;C、不正确,产生新的杂质;D、不正确,HCl与NaOH也反应。
本题难度:简单
3、填空题 高铁酸钾(K2FeO4)是新型多功能水处理剂,碱性条件下性质稳定,其生产过程如下:

请回答下列问题
(1)氯碱工业制Cl2的化学反应方程式??????????????????????????????????;
(2)生成“反应液Ⅱ”的离子方程式是??????;(3)使用碱性KClO的原因是????;
(4)从“反应液II”中分离出K2FeO4后?,副产品是KCl和??????(填化学式),该混合物可用?????????方法分离提纯(填字母序号);
A.过滤
B.分液
C.蒸馏
D.重结晶
(5)工业生产3.96t K2FeO4,理论上消耗Cl2的物质的量为______mol。
参考答案:(1)2NaCl + 2H2O 本题解析: 本题解析:
试题分析:(1)氯碱工业就是电解饱和食盐水得到烧碱和氯气;(2)根据流程分析反应液II是利用次氯酸钾氧化铁离子得到FeO42-,结合氧化还原反应离子方程式的书写步骤可得:3ClO- + 2Fe3+ + 10OH- = 2FeO42- + 3Cl- + 5H2O;(3)题目信息:K2FeO4在碱性条件下稳定,反应需在碱性条件下进行;(4)反应中加入了硝酸铁,所以还生成KNO3,硝酸钾的溶解度随温度变化较大,可以用冷却结晶的方法分离;(5)根据氯气与碱反应和次氯酸钾与硝酸铁反应的关系式进行计算。
本题难度:一般
4、实验题 (6分)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。

请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Ca(OH)2溶液中悬浮的CaCO3???????;
(2)从碘水中提取碘?????????????;
(3)用自来水制取蒸馏水????????????????;
(4)分离植物油和水?????????????;
(5)除去粗盐中的泥沙?????????????;
(6)与海水晒盐原理相符的是???????????。
参考答案:(共6分,每空1分)
(1)B?(2)C?(3)A??
本题解析:萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,结晶法适用于不同溶质的溶解度受温度影响不同而分离的一种方法,分液适用于互不相溶的液体之间的一种分离方法,蒸馏是依据混合物中个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,过滤适用于不溶性固体和液体之间的一种分离方法。根据装置图可知,A是蒸馏,B是过滤,C是萃取,D是蒸发
(1)碳酸钙不溶于水,过滤即可,答案选B。
(2)单质碘易溶在有机溶剂中,萃取即可,答案选C。
(3)自来水制取蒸馏水,需要通过蒸馏,答案选A。
(4)植物油不溶于水,分液即可,答案选C。
(5)泥沙不溶于水,过滤后蒸发结晶即可,答案选BD。
(6)与海水晒盐原理相同的是结晶,答案选D。
本题难度:简单
5、选择题 现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-和NO3-的相互分离。相应的实验过程如下:
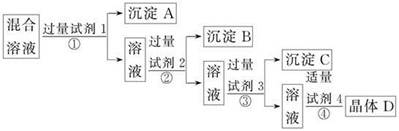
下列关于四种试剂顺序正确的是
A.氯化钡溶液、硝酸银溶液、碳酸钠溶液、硝酸溶液
B.硝酸银溶液、氯化钡溶液、碳酸钠溶液、硝酸溶液
C.氯化钡溶液、硝酸银溶液、硝酸溶液、碳酸钠溶液
D.硝酸银溶液、碳酸钠溶液、氯化钡溶液、硝酸溶液
参考答案:A
本题解析:Cl-可用AgNO3沉淀,SO42-可用Ba2+沉淀,由于Ag2SO4微溶于水,故SO42-的除去应在Cl-之前;由于加入的试剂是过量的,所以过量的AgNO3、BaCl2必须除去,可选用Na2CO3,而过量的Na2CO3可用稀硝酸来除去,所以正确答案为A项。
本题难度:一般
|