微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g)在常温下不能发生,则该反应的△H>0
B.0.1 mol·L?-1CH3COOH溶液加水稀释后,溶液中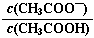 的值减小
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
参考答案:BD
本题解析:
试题分析:A、判断反应自发进行的因素有熵判据和焓判据,只根据其中一个不能准确判断,错误;B、CH3COOH溶液加水稀释平衡正向移动,溶液中醋酸根离子的物质的量增大,醋酸分子的量减少,故溶液中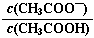 的值减小,正确;C、铅蓄电池在放电过程中,正负极均产生硫酸铅,质量均增加,错误;D、沉淀的转化,正确。
的值减小,正确;C、铅蓄电池在放电过程中,正负极均产生硫酸铅,质量均增加,错误;D、沉淀的转化,正确。
本题难度:一般
2、填空题 (2008淄博一模,16)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:

(1)配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%
的NaOH溶液,需要称取????gNaOH固体。
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式???????????????????????????。
(3)如图,组装好仪器,接通开关K,通电约25min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:
阳极???????????????????????????????
阴极???????????????????????????????
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式?????????????????
参考答案:(1)38.4? (2)Al2O3+2OH-+3H2O=2[
本题解析:本题考查溶液配制的计算、离子方程式和电解方程式的书写,中等题。(1)根据m(溶质)=ρ(溶液)×V(溶液)×W%计算;(2)该反应为NaOH与Al2O3的反应;(3)阳极为Al放电,产物为Al2O3;阴极为H+放电,产物为H2。(4)为氨水和硫酸的反应。
本题难度:一般
3、填空题 (14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
元素
| A
| B
| C
| D
|
性质
结构
信息
| 工业上常用电解熔融AD2制取A的单质。
| B的最外层电子数比最内层电子数多1。
| C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。
| D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。
请按要求回答下列问题:
(1)工业上制取A的单质的化学方程式: 。
(2)在25oC、10l kPa下,已知13.5g的B的固体单质在D的气体单质中完全燃烧后恢复至原状态,放热419 kJ,该反应的热化学方程式是 。
(3)Sn与元素C同主族,周期数比元素C的大2.则Sn的原子序数为 ;配制SnCl2溶液时需用盐酸溶解其晶体,其目的是 。
(4)甲中各原子都满足8电子稳定结构,其电子式为 ;甲溶于水后光照一段时间溶液酸性增强的原因(用离子方程式表示) 。
(5)将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中。写出负极反应的电极方程式 。
参考答案:(1)MgCl2(熔融)电解Mg+Cl2↑ (
本题解析:
试题分析:A、B、C、D为原子序数依次增大的四种第三周期元素,工业上常用电解熔融AD2制取A的单质,说明A应该是活泼的金属镁。B的最外层电子数比最内层电子数多1,因此B的原子序数是13,是铝元素。C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂,则C是硅元素。D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强,该弱酸性物质应该是次氯酸,即D是氯元素。甲的相对分子质量是3×29=87,所以甲是Cl2O。
(1)工业上电解熔融的氯化镁冶炼单质镁,反应的化学方程式为MgCl2(熔融)电解Mg+Cl2↑。
(2)13.5g的铝的物质的量是13.5g÷27g/mol=0.5mol,完全与氯气反应放出419 kJ的热量,因此2mol完全反应放出的热量是419 kJ×4=1676kJ,则反应的热化学方程式为2Al(s)+3Cl2(g)=2AlCl3(s) △H=-1676kJ/mol。
(3)Sn与元素硅同主族,周期数比元素硅的大2.则Sn的原子序数为14+18+18=50;+2价的锡在溶液中易水解,因此配制SnCl2溶液时需用盐酸溶解其晶体的目的是抑制SnCl2水解。
(4)甲中各原子都满足8电子稳定结构,这说明氧元素形成2对共用电子对,因此其电子式为 ;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。 ;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。
(5)镁的金属性强于铝,但与氢氧化钠溶液反应的是铝,而不是镁,所以将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中镁是正极,铝是负极,负极反应的电极方程式为Al-3e-+4OH-=AlO2-+2H2O。
考点:考查元素推断、金属冶炼、热化学方程式、元素周期表的结构、电子式、次氯酸以及原电池原理等
本题难度:困难
4、选择题 在理论上不能用于设计原电池反应的是( )
A.Al(OH)3(s)+NaOH(aq)===NaAlO2(aq)+H2O(l);ΔH<0
B.CH3CH2OH(l)+3O2―→2CO2(g)+3H2O(l);ΔH<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s);ΔH<0
D.H2(g)+Cl2(g)===2HCl(g);ΔH<0
参考答案:A
本题解析:原电池反应的本质是发生氧化还原反应,且为自发的氧化还原反应;A反应为非氧化还原反应,不能用于设计原电池;
本题难度:一般
5、选择题 某电化学实验装置如图所示,下列说法正确的是
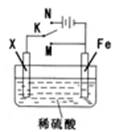
A.若X为碳棒,开关K置于M处,则溶液中的H+移向Fe极
B.若X为碳棒,开关K置于N处,转移0.2mole一时析出0.lmolO2
C.若X为铜棒,开关K置于M或N处,均可减缓铁的腐蚀
D.若X为锌棒,开关K置于M或N处,锌电极上反应均为Zn-2e一=Zn2+
参考答案:D
本题解析:
试题分析:A.若X为碳棒,开关K置于M处,则装置是原电池,Fe是负极,C作正极,根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中的H+移向负电荷较多的正极C棒。错误。? B.若X为碳棒,开关K置于N处,该装置为电解池,转移0.2mole一时析出0.05molO2。错误。??? C.若X为铜棒,开关K置于M处,Fe、Cu及硫酸构成原电池,Fe作负极,可以加快铁的腐蚀;若开关K置于N处,Cu为阳极,发生反应失去电子,而Fe作阴极而被保护,因此可减缓铁的腐蚀。错误。D.若X为锌棒,开关K置于M处,构
本题难度:一般
|