微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 已知在20℃时,每100g水溶解0.148g Ca(OH)2即达饱和。
(1)在20℃500g水中加入7.4g Ca(OH)2粉末,经充分搅拌后过滤,若液体体积仍为500mL,
求OH-离子的物质的量浓度。
(2)若使原500mL溶液中的c(Ca2+)降低至0.01mol·L-1,求需要通入标准状况下二氧化碳气体
多少升?
参考答案:(1)0.04 mol/L??(2)0.112 L
本题解析:
试题分析:已知在20℃时,每100g水溶解0.148g Ca(OH)2即达饱和。则500g水中加入7.4g Ca(OH)2粉末,得饱和溶液,溶液中Ca(OH)2的质量为0.74g其中n(OH-)=0.02mol所以c(OH-)=0.04mol/L
溶液中Ca2+的物质的量为0.01mol,如使c(Ca2+)降低至0.01mol·L-1,需将0.005molCa2+沉淀,需要通入0.005mol二氧化碳气体,标准状况下体积为0.112L.
本题难度:一般
2、选择题 下列指定物质在_定条件下完全反应,转移2mol e-的是??????????????(???)
A.1mol Cl2在点燃条件下与足量铁屑反应
B.1mol NO2与水反应
C.1mol H2O2分解
D.1mol Cl2与NaOH溶液反应
参考答案:A
本题解析:略
本题难度:一般
3、简答题 已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分PbO2→Pb2O3→Pb3O4→PbO.现将a?mol?PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2.加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y?mol.
试回答下列问题:
(1)试写出Pb2O3与浓盐酸反应的化学方程式______.
(2)用含X与a的表达式表示产生的O2、Cl2的物质的量n(O2)=______???n(Cl2)=______
(3)写出y与a、x的函数关系式.______
(4)若两步反应中O2和Cl2的物质的量之比为5:3,则剩余固体中含有的物质为______;其物质的量之比为______.
参考答案:(1)Pb2O3中Pb的化合价只有+3,且+3价的Pb具有氧
本题解析:
本题难度:一般
4、选择题 a g镁铝合金投入xmL,2mol/L的盐酸中,金属完全溶解,再加入ymL,1mol/L NaOH溶液,沉淀达到最大值,质量为(a+1.7)g,则下列说法不正确的是(???)
A.镁铝合金与盐酸反应转移电子数为0.1NA
B.沉淀为Mg(OH)2和Al(OH)3混合物
C.x =2y
D.a的取值范围为0.9g <a<1.2g
参考答案:C
本题解析:
试题分析:B、加入氢氧化钠后的溶液为氯化钠溶液,根据氯离子、钠离子守恒可知n(HCl)=n(NaCl)=n(NaOH),所以x mL×2mol/L="y" mL×1mol/L,即y=2x,故B错误。故选B。
点评:考查镁铝及其化合物的性质、混合物的计算等,难度中等,确定沉淀中含有OH-的质量是解题关键,在利用守恒进行计算。
本题难度:一般
5、计算题 (6分)在标准状况下,将224L HCl气体溶于635mL水(ρ=1.00g·cm-3)中,所得盐酸的密度为1.18g·cm-3。此溶液物质的量浓度应该为多少?若取出这种盐酸10.0mL,向其中加水配制成1L溶液,则所得稀盐酸的物质的量浓度应该为多少?
参考答案:36.5%;11.8mol·L-1;0. 118mol·L-
本题解析:考查物质的量浓度的有关计算。
氯化氢的物质的量是224L÷22.4L/mol=10mol
质量是10mol×36.5g/mol=365g
所以盐酸的质量分数是
w(HCl)=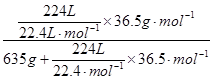 ×100%=36.5%
×100%=36.5%
又因为 本题难度:一般
本题难度:一般