微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
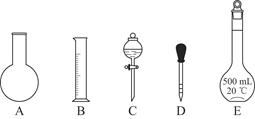
②下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为________g。
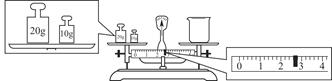
④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_____________________________________________。
参考答案:(1)D
(2)①AC 烧杯、玻璃棒
②BCE
本题解析:(1)托盘天平称量的结果只能精确到小数点后一位数字,D项错误。
(2)容量瓶只能配制溶液,而不能作为反应容器,也不能长时间保存溶液或在其中溶解固体。没有450 mL的容量瓶,故需要配制500 mL的NaOH溶液
本题难度:一般
2、选择题 有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)为[???? ]
A.(y-2x)/a mol/L
B.(y-x)/a mol/L
C.(2y-2x)/a mol/L
D.(2y-4x)/a mol/L
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列各组物质中,原子数相同的是(?? )
A.2 L CO和2 L O2
B.标准状况下2 mol CO2和44.8 L水
C.0.2 mol H2和4.48 L HCl
D.同温同压下,2L氧气和2L氯气与氯化氢的混合气
参考答案:D
本题解析:A:气体并没有标明状况,没有意义;B:水为液态,不用计算即可估算出后者的原子数要大得多;C:同样,气体没有指明状况。选D
本题难度:一般
4、选择题 标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρ g/ml,质量分数为W,物质的量浓度为c mol/L,则下列关系中不正确的是 ( )
A.W="17c/" (1000ρ)
B.ρ=(17V+22400)/(22.4+22.4V)
C.W="17V/(17V+22400)"
D.c=1000Vρ/(17V+22400)
参考答案:B
本题解析:
解答此题直接用概念来求和取1个单位(如1L)来计算。B选项的错误在于它将溶液的体积误作“水的体积加气体的体积”。A选项:取1L溶液计算-质量分数等于溶质的质量除以溶液的质量,1L溶液中有NH3物质的量等于cmol/(L·1L),故NH3的质量等于17c g,溶液的质量等于1000ml*ρg/ml,所以ω=17c/(1000ρ) A项正确;C选项:按照实际发生的物质的质量进行的计算---NH3的质量等于(VL/22.4L/mol)17g/mol="(17V/22.4)g" ,溶液的质量等于NH3的质量加上1L水的质量即1000g,故ω="(17V/22.4)/[(17V/22.4)+1000" ]=17V/(17V+22400) C选项正确;D选项:运用物质的量浓度与质量分数之间的换算关系c=1000ρω/M,将C项中的ω代入,M等于17代入即得 。D选项正确。
本题难度:困难
5、选择题 下列叙述中正确的是 ( )
①在标准状况下,0.2 mol任何物质的体积均为4.48 L
②当1 mol气体的体积为22.4 L时,它一定处于标准状况下
③标准状况下,1 L HC1和1 L H2O的物质的量相同
④标准状况下,lg H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③④
B.②③⑥
C.⑤⑥
D.④⑥
参考答案:D
本题解析:
试题分析:①在标准状况下,0.2 mol任何气体的体积均为4.48 L,①错误;②当1 mol气体的体积为22.4 L时,它不一定处于标准状况下,②错误;③标准状况下水不是气态,不能适用于气体摩尔体积,因此1 L HC1和1 L H2O的物质的量不相同,③错误;④标准状况下,lg H2和14 g N2的物质的量均是0.5mol,体积相同,④正确;⑤28 g CO的物质的量是1mol,但体积不一定为22.4 L,⑤错误;⑥同温同压下,气体的密度与气体的相对分子质量成正比,⑥正确,答案选D。
考点:考查物质的量及气体摩尔体积和阿伏加德罗定律的有关计算与判断
本题难度:一般