微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中Cl-浓度由大到小的顺序是①200mL 2mol/L MgCl2溶液②1000mL 2.5mol/L NaCl溶液③300mL 5mol/L KClO3溶液 ④25
④25 0mL 1mol/L AlCl3溶液
0mL 1mol/L AlCl3溶液
A.③②①④
B.④①②③
C.①④②③
D.②③①④
参考答案:C
本题解析:略
本题难度:一般
2、选择题 下列说法正确的是
A.O2的摩尔质量是32
B.摩尔是物质的量的单位
C.1 mol任何物质都约含有6.02x10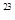 个原子
个原子
D.物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4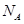 (
(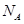 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值)
参考答案:B
本题解析:
试题分析:A.摩尔质量的单位是g/moL,A错误;B.摩尔是国际单位制的一个基本物理量---物质的量的单位,B正确;C.组成物质的有原子、分子、离子等,应为1 mol任何物质都约含有6.02x10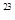 个微粒,C错误;D.没有体积,无法计算离子个数,D错误;选B。
个微粒,C错误;D.没有体积,无法计算离子个数,D错误;选B。
考点:考查摩尔质量的概念,物质的量的单位及计算。
本题难度:一般
3、计算题 硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+ ),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH3 56. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将 (填“偏高”、或“偏低”或“不变”)。
(2)氨气常用 检验,现象是 。
(3)通过计算确定银硫酸镍铵的化学式(写出计算过程)。
参考答案:
(1)偏高 (2)湿润的红色石蕊试纸 试纸
本题解析:本题为一道定量分析的计算题,首先要弄清楚计算什么,怎么计算。
(1)Ni2+含量的测定是通过EDTA滴定法来测定的。要找到误差分析的依据,该滴定法类似于酸碱滴定方法。若滴定前,滴定管未用EDTA标准液润洗,则EDTA标准液的浓度就会偏低,则滴定消耗的EDTA标准液的体积就会偏高,测得的Ni2+含量就会偏高。
(2)氨气的检验有两种常用的方法:①浓盐酸,具体是用玻璃棒蘸取浓盐酸,靠近待测气体,若产生白烟,则为氨气。②试纸法。有两种常用的试纸,一种是湿润的酚酞试纸,湿润的酚酞试纸变红;另一种是湿润的紫色(或红色)石蕊试纸,试纸变蓝。
(3)实验①用EDTA滴定Ni2+由此可以计算出原100mL溶液,即2.3350g样品含Ni2+ 为
n(Ni2+)=0.04000×31.25×10-3×4=0.005mol
实验②发生的反应为:NH4++OH-=NH3 ↑+H2O可得出原2.3350g样品含NH4+为
N(NH4+)=n(NH3)=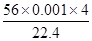 =0.01mol
=0.01mol
又根据电荷守恒:n(Ni2+)×2 + n(NH4+)×1= n(SO42-)×2
即原2.3350g样品含SO42-为n(SO42-)=0.01mol
综上可以得出上述三种离子的质量,m(Ni2+)=0.005×59=0.295g
M(NH4+)=0.01×18=0.18g m(SO42-)=0.01×98=0.98g
则H2O的质量m(H2O)=2.3350-0.295-0.18-0.98=0.9g n(H2O)=0.05mol
x:y:m:n=n(NH4+):n(Ni2+):n(SO42-):n(H2O)="0.01" :0.005 :0.01 :0.05="2" :1 :2:10
硫酸镍铵的化学式为(NH4)2Ni(SO4)2·10H2O
【考点定位】本题考查定量分析实验中常见滴定法的理解应用能力、知识的迁移能力和基本的计算能力。难度中档偏上。
本题难度:一般
4、选择题 要把12mol/L的盐酸(密度1.10g/cm3)50mL稀释成6mol/L 的盐酸(密度1.10g/cm3),需加水 [???? ]
A.50mL
B.50.5mL
C.55mL
D.59.5mL
参考答案:C
本题解析:
本题难度:简单
5、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.1mol钠含有的电子数为23 NA
B.标准状况下,22.4L氯气所含的氯原子数为NA
C.16g氧气中所含的氧原子数NA
D.18g水含有 NA个氢原子
参考答案:C
本题解析:
试题分析:A.一个钠原子中有11个电子,1mol钠含有的电子数为11 NA,错误;B.氯气是双原子分子,标准状况下,22.4L氯气所含的氯原子数为2NA,错误;C.16g氧气的物质的量为0.5mol,所含的氧原子数NA,正确;D.18g水的物质的量为1moL,含有 2NA个氢原子,错误;选C。
考点:考查阿伏伽德罗常数的计算。
本题难度:一般