微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
|
已知 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表
H2(g)
Br2(g)
HBr(g)
1mol分子中化学键断裂需要吸收的能量/kJ
436
a
369
则表中a为 [???? ]
A.404
B.260
C.230
D.200
参考答案:D
本题解析:
本题难度:一般
2、填空题 (1)已知:
① C(s)+O2(g)=CO2(g);△H=-393.5kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g);△H=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=_____________。
(2)已知298K时下列反应的焓变为
① CH3COOH(l)+2O2(g) = 2CO2(g)+2H2O(l) △H1(298K)= -870.3kJ·mol-1
② C(s)+O2(g) = CO2(g) △H2(298K)= -393.5kJ·mol-1
③ H2(g) +1/2O2(g) = H2O(l) △H3(298K) = -285.8kJ·mol-1
计算在此温度下2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应焓变。△H=_____________。
(3)已知下列各组热化学方程式
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640kJ/mol
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式_____________________。
参考答案:(1)-80kJ·mol-1
(2)-488.3kJ·
本题解析:
本题难度:一般
3、选择题 已知:
2CO(g)+O2(g)=2CO2(g) △H= -566 kJ/mol
N2(g)+O2(g) =2NO(g)△H=+180 kJ/mol
则2CO(g)+2NO(g)=N2(g)+ 2CO2(g)的△H是
[???? ]
A.-386 kJ/mol
B. +386 kJ/mol
C.?-746 kJ/mol
D. +746 kJ/mol
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列与化学反应能量变化相关的叙述正确的是 [???? ]
A.生成物能量一定低于反应物总能量
B.放热反应不必加热就一定能发生
C.应用盖斯定律,可计算某些难以直接测量的反应的焓变
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同
参考答案:C
本题解析:
本题难度:简单
5、简答题 开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ?mol-1
③H2O(g)=H2O(l)△H3=-44.0kJ?mol-1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______.
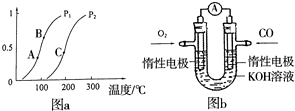
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)?CO(g)+3H2(g)
①一定条件下CH4的平衡转化率与温度、压强的关系如图a.则,Pl______P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为______.(填“<”、“>”“=”)
②100℃时,将1molCH4和2molH2O通入容积为100L的反应室,反应达平衡的标志是:______.
a.容器内气体密度恒定
b.单位时间内消耗0.1molCH4同时生成0.3molH2
c.容器的压强恒定
d.3v正(CH4)=v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K=______
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为______.用该原电池做电源,常温下,用惰性电极电解200mL饱和食盐水(足量),消耗的标准状况下的CO224mL,则溶液的pH=______.(不考虑溶液体积的变化)
(4)氢氧燃料电池的三大优点是:______、______、能连续工作.
参考答案:(1)已知:①2CH3OH(l)+3O2(g)═2CO2(g
本题解析:
本题难度:一般