微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为
A.0.2 mol
B.0.4 mol
C.0.6 mol
D.0.8 mol
参考答案:A
本题解析:
试题分析:纵观反应始终,容易看出只有两种元素的价态有变化,其一是Cu到Cu(NO3)2,每个Cu升2价,失2个电子;另一个是HNO3到NaNO2,每个N降2价,得2个电子。51.2gCu共失电子 ×2=1.6mol,根据电子转移守恒可知,铜失去的电子等于HNO3到NaNO2得到的电子,所以溶液中n(NaNO2)=
×2=1.6mol,根据电子转移守恒可知,铜失去的电子等于HNO3到NaNO2得到的电子,所以溶液中n(NaNO2)=  =0.8mol。气体与氢氧化钠反应的盐溶液为NaNO3、NaNO2混合溶液,根据钠离子守恒有n(NaNO3)+n(NaNO2)=n(Na+),所以溶液中n(NaNO3)=n(Na+)-n(NaNO2)=0.5L×2mol/L-0.8mol=0.2mol。选择A选项。
=0.8mol。气体与氢氧化钠反应的盐溶液为NaNO3、NaNO2混合溶液,根据钠离子守恒有n(NaNO3)+n(NaNO2)=n(Na+),所以溶液中n(NaNO3)=n(Na+)-n(NaNO2)=0.5L×2mol/L-0.8mol=0.2mol。选择A选项。
考点:有关混合物反应的计算
本题难度:一般
2、填空题 在水溶液中,YO3n—和S2-发生反应的离子方程式如下:
YO3n—+3S2-+6H+===Y-+3S↓+3H2O
(1)YO3n—中Y元素的化合价是________。
(2)Y元素原子的最外层电子数是________。
(3)比较S2-和Y-的还原性强弱________________。
参考答案:+5? (2分) 7? (2分)? S2->Y-(2分)
本题解析:根据方程式可知,Y的最低价是-1价,所以属于第ⅦA,最外层电子数是7个。YO3n—中Y元素的化合价是+(2×3-1)=+5价。氧化还原反应中,还原剂的还原性大于还原产物的,所以S2-和Y-的还原性强弱是S2->Y-。
本题难度:一般
3、选择题 一定量NO2与0.5mol?O2混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,发生反应的有关物质物理量的描述一定正确的是(NA表示阿伏加德罗常数)( )
| 二氧化氮 | 碳 | 二氧化碳 | 转移的电子
A
0.5mol
后一反应等于2NA
B
小于6g
后一反应小于2NA
C
92g
前一反应为2mol
D
44.8L
6g
A.A
B.B
C.C
D.D
参考答案:BC
本题解析:
本题难度:一般
4、选择题 下列化学用语正确的是
A.镁离子的结构示意图: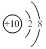
B.乙酸乙酯的结构简式:C4H8O2
C.二氧化碳分子的电子式: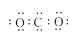
D.次氯酸钙的电离方程式:Ca(ClO)2=Ca2++2ClO一
参考答案:D
本题解析:
试题分析:A.镁离子的结构示意图中质子数是12,A错误;B.C4H8O2是乙酸乙酯的分子式;C.二氧化碳分子的电子式: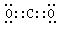 ,C错误;只有D正确。 ,C错误;只有D正确。
本题难度:简单
5、选择题 下列叙述中能表明金属甲的活动性比金属乙的活动性强的是( )。
A.在氧化还原反应中,甲失电子数比乙多
B.同价态阳离子甲比乙氧化性强
C.甲能跟盐酸反应放出H2而乙可与冷水反应产生H2
D.甲、乙与H2SO4溶液形成原电池,乙上冒气泡
参考答案:D
本题解析:元素的金属性强弱取决于失电子的难易,而与失电子多少无关;阳离子氧化性越强,则其对应的金属的还原性越弱;C项中乙与冷水反应生成H2,说明乙比甲金属活动性强;而D项中乙上冒气泡,说明甲失电子,金属性比乙强。
本题难度:一般
|