20.00
?
该漂白粉中有效成分的质量分数为????????。若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将?????????(填“偏高”、“偏低”或“无影响”)
参考答案:Ⅰ、(1)KCl(1分)
(2)2KMnO4+10KC
本题解析:
试题分析:Ⅰ、根据题意可知含七种物质的氧化还原反应为2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2+8H2O,化合价升高的物质为KCl;氧化剂为KMnO4?;??1mol氧化剂得电子5mol ;
Ⅱ、因为氯气有毒,所以x试剂为NaOH,吸收多余的氯气;装置③制取漂白粉,反应为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;为避免温度较高时发生副反应,可将装置③放于冷水浴中进行实验;(3)反应中消耗的KI的平均体积为20.00mL,其物质的量为
本题难度:困难
2、选择题 下列说法正确的是? ( )。
A.实验室可用加热分解碳酸钙的方法制取二氧化碳气体
B.二氧化硫易溶于水,硫酸工厂的尾气可以直接用水吸收
C.二氧化氮可与水反应而被吸收,故硝酸工业的尾气应该用水吸收
D.配制较高浓度的碘水时,应先将碘溶于酒精中,再加水稀释
参考答案:D
本题解析:CaCO3分解的温度较高,不适合实验室制CO2,A错误;工业上是用碱液来吸收二氧化硫气体的,B错误;水与二氧化氮反应的同时会产生NO,C错误;碘在酒精中的溶解度大,而酒精与水能以任意比互溶,故D正确。
本题难度:一般
3、填空题 二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是______ 。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
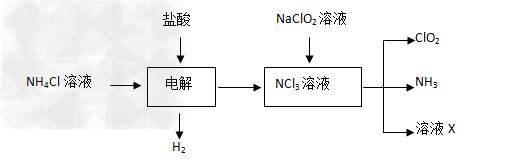
(2)写出电解时发生反应的化学方程式:??????????????????????????????????????????????????;
(3)除去ClO2中的NH3可选用的试剂是??????????????????????????;(填序号)
???????? A.饱和食盐水?????? B.碱石灰???????? C.浓硫酸??????????D.水
(4)测定ClO2(如下图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液。

①装置中玻璃液封管的作用是_________ ;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ______________;
③滴定终点的现象是:___________。
④测得通入ClO2 的质量m(ClO2)= ___________。(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(PH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-。2001年我国卫生部规定,饮用水的ClO2-含量应不超过0.2mg/L。若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是 __________(填化学式)。
参考答案:(1)1:2???????????????
(2)NH
本题解析:
本题难度:一般
4、填空题 标准状况,体积来源:91 考试网相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解。

(1)从物质分类的角度可以推测物质的性质。其中SO2属于_______氧化物(填“酸性”、“碱性”或“两性”)。
SO2?+ (????????? ) → 含氧酸盐。
SO2?+ (????????? ) → 盐 +? (????????? )。
(2)装有NO2的试管倒立在盛有足量水的水槽时,反应的化学方程式为___________________。实验现象为______________________________________________________________________。
(3)装有NH3的试管进行实验时,实验完毕试管内溶液的物质的量浓度为???????。
(4)装有Cl2的试管倒立在盛有足量水的水槽中经过充分的光照,实验结束试管中剩余的气体是?????,生成该气体先后发生的化学方程式有??????????????????、????????????。
参考答案:(1)酸性???碱性氧化物???碱???水
(2)3N
本题解析:
试题分析:(1)酸性氧化物是一类能与水作用生成酸或与碱作用生成盐和水或与碱性氧化物反应生成盐的氧化物,故SO2属于酸性氧化物,与碱性氧化物生成含氧酸盐,与碱反应生成盐和水;(2)装有NO2的试管倒立在盛有足量水的水槽时溶液充满试管容积的2/3,气体变为无色,发生的化学方程式为:3NO2+H2O=2HNO3+NO;(3)设试管内NH3的体积为VL,则氨气的物质的量为VL/22.4L/mol,故实验完毕试管内溶液的物质的量浓度为VL/22.4L/mol/VL=1/22.4 mol/L;(4)装有Cl2
本题难度:一般
5、填空题 (14分)瑞典化学家舍勒在研究软锰矿(主要成分是 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
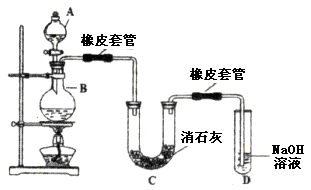
(1)A仪器的名称是__________,所盛试剂是__________,B中发生反应的化学方程式是__________。
(2)漂白粉将在U形管中产生,其化学方程式是____________________。
(3)此实验结果所得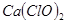 产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应: 产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成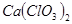 ,为避免此副反应的发生,可采取的措施是______________________________。 ,为避免此副反应的发生,可采取的措施是______________________________。
②试判断另一个副反应(写出此反应方程式):____________________。为避免此副反应发生,应采取的措施是______________________________。
(4)漂粉精同盐酸作用产生氯气: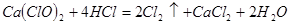 ,该反应中每生成 ,该反应中每生成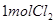 ,转移电子的物质的量为__________ ,转移电子的物质的量为__________ ,被氧化的 ,被氧化的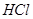 的物质的量为__________ 的物质的量为__________ 。有效氯是漂粉精中有效 。有效氯是漂粉精中有效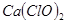 的含量大小的标志。已知: 的含量大小的标志。已知:
有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)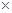 100%,该漂粉精的有效氯为65%,则该漂粉精中 100%,该漂粉精的有效氯为65%,则该漂粉精中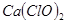 的质量分数为__________(保留一位小数)。 的质量分数为__________(保留一位小数)。
参考答案:1)分液漏斗,浓盐酸, 本题解析:(1)A仪器的名称是分液漏斗,所盛试剂是浓盐酸,B中发生反应的化学方程式是 本题解析:(1)A仪器的名称是分液漏斗,所盛试剂是浓盐酸,B中发生反应的化学方程式是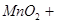 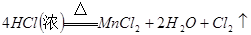 ; ;
(2)漂白粉将在U形管中产生,
本题难度:一般
|