微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在理论上不能用于设计原电池的化学反应是?(????)
A.HCl ( aq ) + NaOH ( aq ) =" NaCl" ( aq ) + H2O ( l ) △H < 0
B.2CH3OH ( l ) +3O2 ( g ) = 2CO2 ( g ) + 4H2O ( l )△H < 0
C.4Fe (OH)2 ( s ) + 2H2O ( l ) + O2 ( g ) =" 4Fe" (OH)3( s )△H < 0
D.2H2 ( g ) + O2 ( g ) = 2H2O ( l )△H < 0
参考答案:A
本题解析:
试题分析:常温能自发进行的氧化还原反应可设计成原电池,有元素化合价变化的反应为氧化还原反应,以此来解答。A中反应是中和反应,没有元素的化合价变化,不是氧化还原反应,因此不能用于设计原电池,故A符合题意;B反应CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O中,C、O元素的化合价变化,属于氧化还原反应,能用于设计原电池,故B不符合题意;C反应Cu(OH)2(s)+2HCl(aq)=CuCl2(aq)+2H2O Fe (OH)2 ( s ) + 2H2O ( l ) + O2 ( g )
本题难度:简单
2、选择题 根据反应:2Ag++Cu=Cu2++2Ag,设计如图所示原电池,下列说法错误的是(?)

A.X可以是银或石墨
B.Y是硫酸铜溶液
C.电子从铜电极经外电路流向X电极
D.X极上的电极反应式为:Ag++e-=Ag
参考答案:B
本题解析:
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式可知,铜失去电子,发生氧化反应,做原电池的负极。溶液中的银离子得到电子,在正极发生还原反应。因此根据装置图可知,X是正极,金属性弱于铜的,或用石墨做电极,电解质溶液是硝酸银,A、C、D正确,B不正确,答案选B。
点评:该题是基础性试题的考查,侧重对学生灵活运用原电池原理解决实际问题的能力的培养,有利于调动学生的学习兴趣和学习积极性。明确原电池
本题难度:一般
3、选择题 下图所示装置能够组成原电池,并且能产生明显电流的是的是( )
A.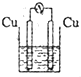
稀硫酸
B.
稀硫酸
C.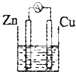
硫酸铜
D.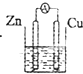
乙醇
参考答案:A.两电极相同,不能形成原电池,故A错误;
B.没有形
本题解析:
本题难度:简单
4、填空题 分碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) △H="-l59.5" kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
③H2O(1)=H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4g NH3转移的电子数为 (阿伏加德罗常数的值用NA表示)。
(4)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)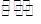 N2(g)+CO2(g) △H="Q" kJ·mol-1。
N2(g)+CO2(g) △H="Q" kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(Min)
浓度(mol·L-1)
| 0
| 10
| 20
| 30
| 40
| 50
|
NO
| 1.00
| 0.58
| 0.40
| 0.40
| 0.48
| 0.48
|
N2
| 0
| 0.21
| 0.30
| 0.30
| 0.36
| 0.36
|
CO2
| 0
| 0.21
| 0.30
| 0.30
| 0.36
| 0.36
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填“>”或“<”)。
参考答案:(1)4NH3+5O2 本题解析: 本题解析:
试题分析:(2)由盖斯定律方程式①+②-③得热化学方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l);△H=-87.0kJ/mol;(3)由原电池原理,结合电解质溶液的碱性确定负极反应式为2NH3+6OH- -6e-=N2+6H2O ;每消耗3.4g NH3转移的电子数为0.6NA;(4)由平衡常数的表达式确定T1℃时,该反应的平衡常数K=c(N2)×c(CO2)/c2(NO)=0.56;30min后气体的浓度均增大,所以可能是通入的NO或缩小了容器的体积;升高温度时三种气体的浓度比值与T1℃平衡状态下增大,所以确定平衡逆向移动,Q <0.
考点:元素化合物知识、盖斯定律、原电池原理、化学平衡及其常数。
本题难度:困难
5、填空题 (17分)I.工业上有一种用CO2来生产甲醇燃料的方法:
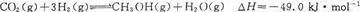
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6 mol。
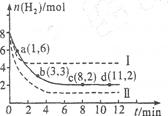
(1)a点正反应速率????????????(填“大于”“等于”或“小于”)逆反应速率。其化学平衡常数K=????????????
(2)下列时间段平均反应速率最大的是?????????????????????,
A.O~1 min
B.1~3 min
C.3~8 min
D.8~11 min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是???????????????,曲线Ⅱ对应的实验条件改变是?????????????????,体积不变再充入3molCO2和4 mol H2,H2O(g)的体积分数?????????????????(填“增大”“不变”或“减小”)
Ⅱ.某实验小组欲探究反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2S04溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、??????????????????、?????????????????;
反应的方程式为?????????????????????????????
Ⅲ. 粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。
(1)电解结束后,在阳极附近的沉淀物中,主要的金属单质为??????????????(填化学式)。
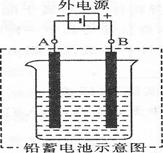
(2) 若按上图所示连接对铅蓄电池进行充电。充电一段时间后。则在A电极上生成??????????????(填化学式)。B电极上的电极反应式为?????????????;充电完毕。铅蓄电池的正极是????????????极(填“A”或“B”)。
(3)如用甲烷燃料电池为电源,在25℃、101 kPa时,若CH4在氧气中直接燃烧生成1 mol水蒸气放热401 kJ,而l g水蒸气转化成液态水放热2.445 kJ,则CH4的燃烧热为???????????????????(取整数)kJ·mol-。
参考答案:Ⅰ(1)大于? 1/2 (2)? A?? (3) 升高温度?
本题解析:Ⅰ(1)a点氢气的物质的量还是在减小的,所以反应是在向正反应方向进行,因此正反应速率大于逆反应速率。平衡时氢气是2mol,则消耗氢气是6mol,所以同时消耗CO2是2mol,生成甲醇和水蒸气是2mol。所以平衡常数等于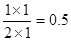 。 。
(2)反应速率越大,反映在曲线上斜率就越大,所以反应速率最大的是O~1 min,即A
本题难度:一般
|