微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组仪器中,能用来准确地配制100mL lmo1/L浓度的稀盐酸的一组是
A.容量瓶、烧杯、玻棒
B.100mL容量瓶、烧杯、玻棒、天平、胶头滴管
C.量筒、100mL容量瓶、烧杯、玻棒、胶头滴管
D.1升容量瓶、烧杯、玻棒、胶头滴管、量筒
参考答案:C
本题解析:
试题分析:浓盐酸配制100mL lmo1/L浓度的稀盐酸需要量筒、100mL容量瓶、烧杯、玻棒、胶头滴管,答案选C。
点评:该题是高考中的常见考点和题型,属于基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,该题的关键是明确配制的原理和基本操作要求,然后灵活运用即可。有利于培养学生规范严谨的实验设计能力,提升学生的学科素养。
本题难度:简单
2、选择题 下列化学药品与其危险化学品图形标志不一致的一组是
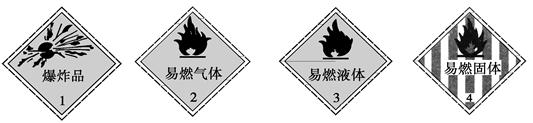
A.烧碱——1
B.甲烷——2
C.酒精——3
D.白磷——4
参考答案:A
本题解析:
试题分析:A.烧碱属于强碱,具有腐蚀性,不属于爆炸品,故A错误;
B.甲烷在常温下为气体,易燃,与化学品图形标志一致,故B正确;
C.酒精在常温下为液体,易燃,与化学品图形标志一致,故C正确;
D.白磷在常温下为固体,着火点低,易燃,与化学品图形标志一致,故D正确。
故选A。
点评:本题考查物质的性质与化学试剂的存放,题目难度不大,注意相关知识的积累,注意化学药品的保存与性质相关。
本题难度:简单
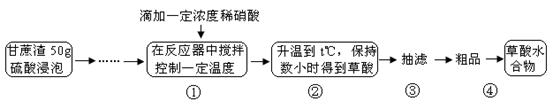
3、实验题 草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。
aaaaaa
?
?
?
 请跟据以上信息回答下列问题: 请跟据以上信息回答下列问题:
⑴图示①②的氧化—水解过程是在上图1的装置中进行的,指出装置A的名称????????。
⑵图示①②的氧化—水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸收率的影响,结果如上图2所示,请选择最佳的反应温度为???????,为了达到图2所示的温度,选择图1的水浴加热,其优点是??????????????????????????。
⑶在图示③④中的操作涉及到抽滤,洗涤、干燥,下列有关说法正确的是?????????。
A.在实验过程中,通过快速冷却草酸溶液,可以得到较大的晶体颗粒,便于抽滤
B.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
C.为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量滤液于试管中进行相关实验。
D.为了得到干燥的晶体,可以选择在坩埚中直接加热,并在干燥器中冷却。
⑷要测定草酸晶体(H2C2O4·2H2O)的纯度,称取7.200g制备的草酸晶体溶于适量水配成250mL溶液,取25.00mL草酸溶液于锥形瓶中,用0.1000mol/L酸性高锰酸钾溶液滴定
(5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O),
①取25.00mL草酸溶液的仪器是????????????????????????。
②在草酸纯度测定的实验过程中,下列说法正确的是:?????????????。
A.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
B.移液管取草酸溶液时,需将尖嘴处的液体吹入锥形瓶,会使实验误差偏低
C.滴定时,左手轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③判断滴定已经达到终点的方法是:??????????????????????????????????????。
④达到滴定终点时,消耗高锰酸钾溶液共20.00mL,则草酸晶体的纯度为?????????????。
参考答案:⑴三颈烧瓶(2分)⑵70℃(1分);便于控制温度,使装置受热
本题解析:
试题分析:(1)根据装置的结构特点可知,A应该是三颈烧瓶。
(2)根据图2可知,在温度为70℃时,醋酸的收率最高,所以选择的最佳反应温度是70℃。由于温度不超过100℃,所以采用水浴加热,这是由于水浴加热时便于控制温度,且能使装置受热均匀。
(3)A、在实验过程中,通过快速冷却草酸溶液,得不到较大的晶体颗粒,应该是自然冷却,A不正确;B、在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失,B正确;C、由于装置中存在压强差,所以为了检验洗涤是否完全,应拔下吸滤瓶与
本题难度:一般
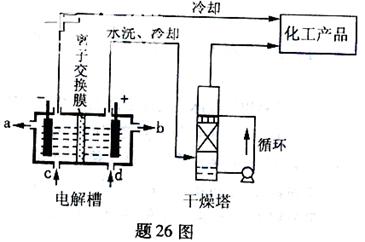
4、填空题 工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)题26图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是????;NaOH溶液的出口为??????(填字母);精制饱和食盐水的进口为??????(填字母);干燥塔中应使用的液体是?????。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为????????????????????????????????????。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) 4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为??kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气????? (标准状况)。 (标准状况)。
参考答案:(1)①氯气;a;d;浓硫酸(2)①SiCl4+2H2+O2
本题解析:(1)电解饱和食盐时阳极阴离子Cl—、OH—放电,Cl—的放电能力强于OH—,阳极发生的方程式为:2Cl——2e—===Cl2↑;阴极:2H++2e—===H2↑;总反应为:2NaCl+2H2O Cl2↑+H2↑+2NaOH。H2、2NaOH在阴极,NaOH溶液的出口为a,Cl2在阳极,精制饱和食盐水从阳极进入,选d;要干燥Cl2需要用酸性干燥剂H2SO4或P2O5等,中性干燥剂无水CaCl2。(2)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可。发生的化学方程式为:SiCl4+2H2+O2 Cl2↑+H2↑+2NaOH。H2、2NaOH在阴极,NaOH溶液的出口为a,Cl2在阳极,精制饱和食盐水从阳极进入,选d;要干燥Cl2需要用酸性干燥剂H2SO4或P2O5等,中性干燥剂无水CaCl2。(2)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可。发生的化学方程式为:SiCl4+2H2+O2 SiO2+4HCl。② SiO2+4HCl。②
由3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) 4SiHCl3(g)
起始量(mol)??????????????? n??????????????????? 0
变化量(mol)???? 3x???????? 2x?????? x?????????? 4x
平衡量(mol)??????????????? n—2x???????????????4x
4x=0.020mol/L×20L=0.4mol,n—2x=0.140mol/L20L=2.8mol,n=3.0mol,由2NaCl+2H2O Cl2↑+H2↑+2NaOH,(2×58.5)g:1mol=m(NaCl)g:3mol;m(NaCl)=351g=0.351kg。 Cl2↑+H2↑+2NaOH,(2×58.5)g:1mol=m(NaCl)g:3mol;m(NaCl)=351g=0.351kg。
(3)由NaCl转化为NaClO3,失去电子数为6,H2O转化为H2,得到的电子数为2,设产生的H2体积为V,由得失电子守恒有:6×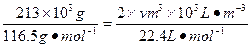 ;V=134.4m3。 ;V=134.4m3。
本题难度:一般
5、实验题 ⑴在实验室进行的下列实验中,有关仪器的下端必须插入液面以下的是??????(填编号)。
①分馏石油时用的温度计?????????????②制备乙烯时用的温度计
③用水吸收溴化氢的导管口???????????④用碱液吸收多余氯气的导管口
⑤制备H2的简易装置中加入稀硫酸用的长颈漏斗
⑥制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液用的胶头滴管
参考答案:②④⑤⑥
本题解析:略
本题难度:简单
|
网站客服QQ: 960335752 - 14613519 - 791315772
|