微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 重晶石矿石主要含有BaSO4,还含有少量有SiO2、Al2O3、Fe2O3、MnO2、FeS2、Na2O、K2O等杂质。以下是某工业制备硫酸钡以及分离某些金属的流程图。
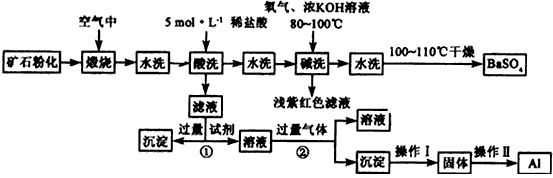
(1)煅烧过程中产生的污染性气体主要是_______________。
(2)确定第一次水洗液中有K+存在的实验现象是_____________。
(3)写出碱洗时的氧化还原反应方程式:_________________。
(4)①反应生成沉淀的化学式__________,②反应的离子方程式为___________________。
(5)操作I为______,操作Ⅱ为_______。
2、填空题 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)发生器中鼓入空气的作用可能是_________________。
(2)吸收塔内发生反应的化学方程式为________________________。
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是___________________。
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是________________________
3、填空题 铝是一种重要的金属,在生产、生活中具有许多重要的用途。眉山市电解铝厂位于三苏故里修文乡,现已经形成年产33万吨电解铝,配套年产15万吨阳级碳块的规模。该厂用铝土矿为原料制备铝的工艺流程如下

已知:
①铝土矿的主要成分是?Al2O3,此外还含有少量CuO、Fe2O3等杂质。?
②电解冶炼铝时用碳棒作阳极,用Na3AlF6作助熔剂,电解熔融的Al2O3。
回答下列问题:??????????
(1)写出铝土矿与?A?溶液反应的化学方程式?________________。
(2)滤渣?C的主要成分为___________;实验室过滤时使用的玻璃仪器有___________。
(3)生成过程中,除CaO、H2O可以循环使用外,还可以循环使用的物质有________?(填化学式)。
(4)写出过量CO2通入滤液C生成D的离子方程式?___________________。
(5)若生产54吨铝,放出平均摩尔质量为36g/mol的气体(经测定气体中不含O2),则消耗阳极______吨。
4、填空题 高铁酸钾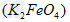 易溶于水,具有强氧化性,是一种新型水处理剂。工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解
易溶于水,具有强氧化性,是一种新型水处理剂。工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解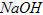 溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。
溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。
(1)高铁酸钾具有强氧化性的原因是___________________。
(2)用异丙醇代替水洗涤产品的好处是____________________。
(3)最近,工业上又用铁的氧化物代替铁丝网制备高铁酸盐,其优点是价廉易得且可提高电能的使用效率。则用 作阳极的电极反应式为________________;若通过相同的电流,分别用铁丝网、
作阳极的电极反应式为________________;若通过相同的电流,分别用铁丝网、 作阳极制得的高铁酸钾的质量之比为_____________。
作阳极制得的高铁酸钾的质量之比为_____________。
(4)探究高铁酸钾的某种性质。
【实验1】将适量K2FeO4固体分别溶解于pH?为?4.74、7.00、11.50?的水溶液中,配得FeO42-浓度为?1.0?mmol/L(1?mmol/L?=10-3?mol/L)的试样,静置,考察不同初始?pH?的水溶液对K2FeO4某种性质的影响,结果见图1(注:800?min后,三种溶液中高铁酸钾的浓度不再改变)。
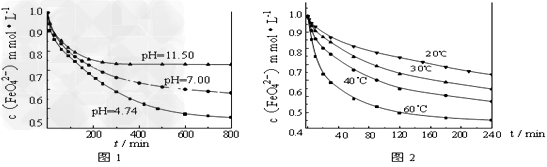
【实验2】将适量?K2FeO4溶解于pH=4.74?的水溶液中,配制成FeO42-浓度为?1.0?mmol/L的试样,将试样分别置于?20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是______________________;
②实验2可得出的结论是_____________________;
③高铁酸钾在水中的反应为4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。由图1可知,
4Fe(OH)3+8OH-+3O2↑。由图1可知,
800?min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是_____________________。
5、选择题 金属陶瓷是一种应用于高科技的复合材料,合成方法是将陶瓷(主要成分:Al2O3、ZrO2等耐高温材料)和粘结金属(主要是Cr、Mo、W、Ti等高熔点金属)研磨混匀成型后,高温烧结使金属仍然以单质的形式存在于金属陶瓷之中,据此判断合成工艺必须 [???? ]
A. 在氧气中合成
B. 在HCl气氛中合成
C. 在氮气气氛中合成
D. 在空气中合成