微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 选做(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。根据下图回答下列问题:

(a)P和Cl2反应生成PCl3的热化学方程式是______________________________ ;
(b)P和Cl2分两步反应生成1 mol PCl5的ΔH3=____________________,P和Cl2一步反应生成1 mol PCl5的ΔH4____________ΔH3(填“大于”.“小于”.或“等于”)。
(2)在微生物作用的条件下,NH经过两步反应被氧化成NO。这两步的能量变化示意图如下:
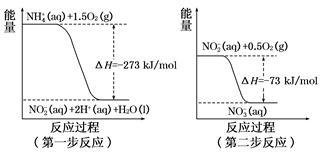
(a)第二步反应是________反应(选填“放热”或“吸热”),判断依据是__________ 。
(b)1molNH4+(aq)全部氧化成NO2-(aq)的热化学方程式是_____________________________________。
参考答案:(1)(a) 本题解析:
本题解析:
试题分析:(1)(a)根据反应过程和能量关系图,得出:P(s)+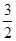 Cl2(g)=PCl3(g)△H=-306kJ·mol-1;(b)P(s)+
Cl2(g)=PCl3(g)△H=-306kJ·mol-1;(b)P(s)+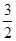 Cl2(g)=PCl3(g)△H1①,PCl3(g)+Cl2(g)=PCl3(g)△H2 ②,①+②得:P(s)+
Cl2(g)=PCl3(g)△H1①,PCl3(g)+Cl2(g)=PCl3(g)△H2 ②,①+②得:P(s)+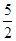 Cl2(g)=PCl5(g)△H3=△H1+△H2=-306-93kJ·mol-1=-399kJ·mol-1;根据盖斯定律,只要是始态和终态不变,无论是一步还是多步完成,反应热不变,填写“等于”;(2)(a)一个反应是放热反应还是吸热反应,决定于反应物的总能量与生成物的的总能量的相对大小,反应物的总能量大于生成物的总能量,此反应是放热反应,△H<0,如果反应物的总能量小于生成物的总能量,此反应是吸热反应,△H>0,根据图中信息,反应物的总能量大于生成物的总量,是放热反应,依据是:△H<0或者反应物的总能量大于生成物的总能量;(b)根据第一步反应的图,热化学反应方程式:NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) △H=-273kJ·mol-1。
Cl2(g)=PCl5(g)△H3=△H1+△H2=-306-93kJ·mol-1=-399kJ·mol-1;根据盖斯定律,只要是始态和终态不变,无论是一步还是多步完成,反应热不变,填写“等于”;(2)(a)一个反应是放热反应还是吸热反应,决定于反应物的总能量与生成物的的总能量的相对大小,反应物的总能量大于生成物的总能量,此反应是放热反应,△H<0,如果反应物的总能量小于生成物的总能量,此反应是吸热反应,△H>0,根据图中信息,反应物的总能量大于生成物的总量,是放热反应,依据是:△H<0或者反应物的总能量大于生成物的总能量;(b)根据第一步反应的图,热化学反应方程式:NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) △H=-273kJ·mol-1。
考点:考查反应热、热化学反应方程式的书写等相关知识。
本题难度:困难
2、选择题 下列关于化学键的说法中正确的是(??)
A.金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性
B.配位键常用A→B表示,其中A原子可以提供接受孤电子对的空轨道
C.含有π键的分子在反应时,π键是化学反应的积极参与者
D.金属元素原子和非金属元素原子间只能形成离子键
参考答案:C
本题解析:金属键是金属阳离子和自由电子之间强烈的相互作用,金属键木方向性和饱和性,A不正确。B不正确,A原子应该是配体。D不正确,例如氯化铝中含有的化学键是共价键,所以正确的答案选C。
本题难度:一般
3、选择题 下列晶体中,化学键种类相同,晶体类型也相同的是
A.CO2和SiO2
B.NaCl和HCl
C.O2和H2O
D.Si和N2
参考答案:C
本题解析:A中前者是含有极性键的分子晶体,后者是含有极性键的原子晶体。B中前者是含有离子键的离子晶体,后者是含有极性键的分子晶体。C中都是含有共价键的分子晶体。D中前者是含有非极性键的原子晶体,后者是含有非极性键的分子晶体。所以答案选C。
本题难度:一般
4、简答题 下列五种物质中①Ar??②H2O2??③NH4NO3??④KOH??⑤Na2O2??⑥CaCl2只存在共价键的是______,只存在离子键的是______,既存在共价键又存在离子键的是______,不存在化学键的是______.(填写序号)
参考答案:①Ar为单原子分子,不存在化学键;
②H2O2为非金属
本题解析:
本题难度:一般
5、选择题 常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:NH+4、Na+、I-、NO-3
B.由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.能使甲基橙变红的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
参考答案:C
本题解析:分析:A.pH=1的溶液显酸性,离子之间发生氧化还原反应;
B.由水电离的c(H+)=1×10-14mol/L的溶液,为酸或碱溶液;
C.能使甲基橙变红的溶液,pH<3.1,溶液显酸性;
D.离子之间结合生成络离子.
解答:A.pH=1的溶液显酸性,H+、I-、NO3-离子之间发生氧化还原反应,则不能共存,故A错误;
B.由水电离的c(H+)=1×10-14mol/L的溶液,为酸或碱溶液,HCO3-既能与酸反应又能与碱反应,则不能共存,故B错误;
C.能使甲基橙变红的溶液,pH<3.1,溶液显酸性,该组离子之间不反应,能共存,故C正确;
D.Fe3+、SCN-离子之间结合生成络离子,则不能共存,故D错误;
故选C.
点评:本题考查离子的共存,明确信息是解答本题的关键,注意发生的氧化还原反应及信息的抽取是解答的难点,题目难度中等.
本题难度:一般