微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 键能是指破坏(或形成)1 mol化学键所吸收(或放出)的能量。化学反应就是旧键断裂和新键形成的过程。现查得:H-H键,Cl-Cl键和H-Cl键的键能分别为436 kJ/mol,243 kJ/mol和431 kJ/mol,请根据此数据计算,由Cl2,H2生成1 mol HCl
时的热效应为[???? ]
A.放热183 kJ
B.放热91.5 kJ
C.吸热183 kJ
D.吸热91.5 kJ
参考答案:B
本题解析:
本题难度:一般
2、填空题 (8分)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备气态甲醛。甲醛与气态甲醇转化的能量关系如图所示:
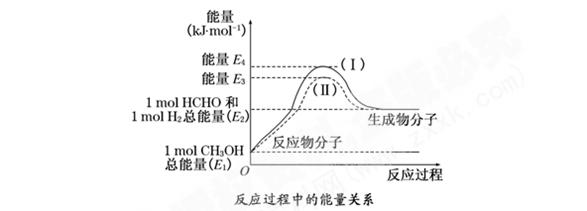
(1)甲醇催化脱氢转化为甲醛的反应是 (填“吸热”或“放热”)反应.
(2)过程Ⅰ与过程Ⅱ的反应热是否相同? ,理由是  。
。
(3)合成甲醇的主要反应为:CO(g)+2H2(g) CH3OH(g)△H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g)△H<0,其化学平衡常数K和温度T的关系如下表所示:
T/℃
| T1
| T2
| T3
|
K
| 1/1000
| 1/40
| 25
T1、T2、T3的大小关系为
参考答案:(共8分)
(1)吸热(2分)
(2)相同(2分
本题解析:略
本题难度:一般
3、填空题 已知化学反应N2+3H2====2NH3的能量变化如图所示。
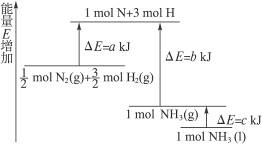
(1)1 mol N 和3 mol H 生成1 mol NH3(g)是_________________能量的过程(填“吸收”或“释放”)。
(2) N2(g)+ N2(g)+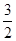 H2(g)====NH3(g) ΔH=_________________。 H2(g)====NH3(g) ΔH=_________________。
(3)N2(g)和H2(g)生成NH3(l)的热化学方程式____________________。
参考答案:(1)释放
(2)(a-b) kJ·mol-1
本题解析:(1)从图示知1 mol N 和3 mol H 具有的总能量比1 mol NH3(g)具有的能量高,故1 mol N 和3 mol H 生成1 mol NH3(g)是释放能量的过程。
(2)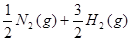 ====NH3(g)的反应热为(a-b) kJ·mol-1。 ====NH3(g)的反应热为(a-b) kJ·mol-1。
(3)N2(g)和H2(g)生成2 mol NH
本题难度:简单
4、选择题 下列各组分子中,均含有非极性键且属于非极性分子的是
A.C2H2、NH3
B.Cl2、C2H4
C.CO2、H2S
D.CH4、H2O2
参考答案:B
本题解析:
试题分析:同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子。A、C2H2中含有极性键和非极性键,是直线型分子,结构对称,分子中正负电荷重心重叠,为非极性分子;NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子,故A错误;B、Cl2为直线形结构,含有非极
本题难度:一般
5、选择题 某反应的△H=-80kJ·mol-1,叙述正确的是( )
A.正反应活化能等于80kJ·mol-1
B.逆反应活化能一定大于80kJ·mol-1
C.逆反应活化能不大于80kJ·mol-1
D.正反应活化能比逆反应活化能小80kJ·mol-1
参考答案:D
本题解析:△H小于0,说明反应是放热反应,因为反应热是活化能和活化分子变成生成物分子所放出的能量的差值,所以正确的叙述是D。答案选D。
本题难度:简单
|