微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 含有a mol FeBr2的溶液中,通入 x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
参考答案:B
本题解析:应用亚铁离子的还原性强于溴离子的,所以氯气首先氧化的是亚铁离子,然后是溴离子,所以选项B是错误的,其余都是正确的,答案选B。
本题难度:一般
2、选择题 下列必须加入氧化剂才能实现的是?????????????????????????????(????)


A.Fe3+Fe2+-
B.SO2SO42-


C.H2O2O2
D.SO2SO32-
参考答案:B
本题解析:略
本题难度:简单
3、选择题 下列事实与结论相符且正确的是( )
A.100mL、1mol?L-1AlCl3溶液中加入400mL、1mol?L-1NaOH溶液,AlO2-数目为0.1NA(NA代表阿伏加德罗常数)
B.由于Ksp(AgI)<Ksp(AgBr),所以一定不能将AgI转化为AgBr
C.常温下,当NaOH溶液滴定CH3COOH溶液时,当刚好完全中和时,溶液的pH=7
D.0.1mol?L-1Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
参考答案:A、氯化铝 的物质的量与氢氧化钠的物质的量之比为1:4,所以
本题解析:
本题难度:一般
4、填空题 (10分)高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂。
(1)高铁酸钾具有强氧化性的原因是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ,____ _____。
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法。
①干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子 mol。
②湿式氧化法的流程如下图:
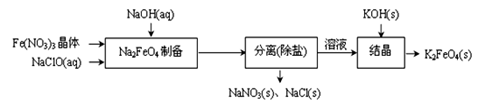
上述流程中制备Na2FeO4的化学方程式是: 。
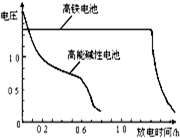
(4)高铁电池是正在研制中的可充电电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 。
参考答案:(1)其中的铁元素为+6价,易得电子(2分)
(2)高
本题解析:
试题分析:(1)高铁酸钾中的铁是+6价,处于高价态,易得电子,具有强氧性。
(2)高铁酸钾是具有强氧性,还原产物铁离子水解生成氢氧化铁胶体,具有吸附杂质、絮凝的作用。
(3)①2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,6molNa2O2中12mol的负一价氧,2mol的有变成0价,还有10mol变成-2价,而铁是+2价变为+6价,所以每生成2mol Na2FeO4时转移电子10mol;
②Fe(NO3)3被NaClO氧化成Na2FeO4,反应的化学方程式为2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O;
(4)高铁电池由图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定等优点,故答案为:放电时间长;工作电压稳定。
考点:考查高铁酸钾的性质、应用以及准备的有关判断与计算
本题难度:困难
5、选择题 下列反应不属于氧化还原反应的是
A.3Cl2+6 KOH====5KCl+KClO3+3H2O
KOH====5KCl+KClO3+3H2O
B.2NO2+2NaOH====NaNO3+NaNO2+H2O
C.Fe2O3+2Al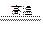 2Fe+Al2O3
2Fe+Al2O3
D.SnCl4+2H2O===SnO2+4HCl
参考答案:D
本题解析:略
本题难度:简单