?
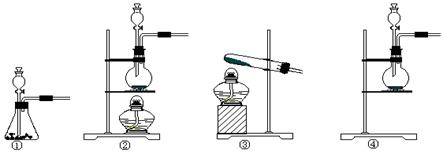
(1)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中。

(2)上述气体中,从反应中有无电子转移的角度看,明显不同于其他气体的是??????,写出实验室制取该气体的化学方程式?????????????????????????????????????????????.
(3)若用上述制备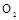 的装置制备 的装置制备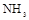 ,应选择的试剂为?????????????????????. ,应选择的试剂为?????????????????????.
(4)制备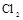 需用 需用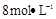 的盐酸1OOml,现用 的盐酸1OOml,现用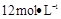 的盐酸来配制。 的盐酸来配制。
①需要用量筒量取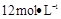 的盐酸的体积为????????????mL; 的盐酸的体积为????????????mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号)???????????????。
A.100mL量筒?????? B.托盘天平??????? C.玻璃棒????????? D.50mL容量瓶
E.lOmL量筒??????? F.胶头滴管??????? G.lOOmL烧杯?????? H.lOOmL容量瓶
③下列实验操作中,不正确的是????????????????????????(填写标号)。
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
参考答案:(共15分)(1)(每空1分,共3分)
编号
发
本题解析:(1)考查常见气体的制备。双氧水分解不需要加热,因此选择C装置;实验室制取氨气是利用固体之间的反应,且反应需要加热,所以选择B装置;实验室制取氯气是利用固体和用液体之间的反应,且反应需要加热,选择A装置,如果用高锰酸钾溶液氧化浓盐酸,则不需要加热,因此也可以选择C装置。
(2)实验室制取氨气是非氧化还原反应,而制取氧气和氯气的反应都是氧化还原。实验室制取氨气的方程式是Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O。 CaCl2+2NH3↑+2H2O。
(3)如果不需要加热制取氨气,则可以利用氨水的不稳定性,易分解生成氨气来实现,即可以将浓氨水滴入生石灰或氢氧化钠固体。
(4)①盐酸的物质的量是0.1L×8mol/L=0.8mol,所以需要浓盐酸的体积是0.8mol÷12molL=0.0667L=66.7ml。
②量取浓盐酸需要100ml量筒,溶解需要烧杯和玻璃棒,转移需要100ml容量瓶。定容需要胶头滴管,所以答案选ACFGH。
③容量瓶不能润洗,选项B不正确;容量瓶不能用来稀释,选项C不正确,其余都是正确的,答案选BC。
本题难度:一般
3、实验题 (13分)某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO4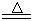 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
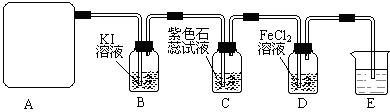
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______? (NA表示阿伏加德罗常数)。
(2)该实验中A处可选用装置__________?????????? _____ (填写装置的序号)。
(3)装置B中发生反应的离子方程式为________________________________________。
(4)装置C中的现象为___________________________________________________,
试结合反应方程式解释其原因 __________________________________???????_
_________________________________?????????????????????????????????????。
(5)装置E中的试剂是______________(任填一种合适试剂的名称),其作用是________
_______________________________?????????????????????????????????? ______。
(6)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验 步骤) 步骤)
_________________________________________________________________________
_________________________ __________________________??????? ______________ __________________________??????? ______________
参考答案:(13分) (1) NA????(2分) 本题解析:略 本题解析:略
本题难度:简单
4、选择题 下列实验设计方法正确的是
A.向卤代烃加硝酸酸化的硝酸银来检验其中的卤族素元素
B.实验用NH4Cl固体受热分解来制备NH3
C.用盐酸和澄清石灰水来检验某物质是否含有CO32-
D.可用下图所示的装置和药品来研究反应物浓度对反应速率的影响

参考答案:D
本题解析:
试题分析:A. 在卤代烃中卤素是以原子的形式存在的。检验的方法是将卤代烃与NaOH水溶液共热,然后加入硝酸酸化,再加硝酸银来检验其中的卤族素元素。错误。B. 在实验用NH4Cl固体与碱共热来制备NH3。错误。C. 向某物质中加入盐酸,若产生无色、无味能使澄清石灰水变浑浊的气体,就证明原物质中含有CO32-或HCO3-。错误。D.若硫酸的浓度大,在在相同的时间内产生氢气的体积大,若浓度小,产生的氢气的体积小。因此可用如图所示的装置和药品来研究反应物浓度对反应速率的影响。正确。
本题难度:一般
5、实验题 (13分)(1)如图所示装置,为实现下列实验目的,其中y端适合于作入口的是_____多项)
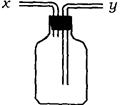
A 瓶内盛液体干燥剂,用以干燥气体
B 瓶内盛液体洗涤剂,用以除去某气体中的杂质
C 瓶内盛水,用以测量某难溶于水的气体的体积
D 瓶内贮存气体,加水时气体可被排出
E 收集密度比空气大的气体
F 收集密度比空气小的气体
(2) 浓H2SO4和木炭在加热时发生反应的化学方程式是_______________________。
图中虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,

填写下列空白。
①A中无水硫酸铜的作用_____________。
②证明SO2一定存在的现象是_____________。
③C中酸性KMnO4溶液的作用_____________。
④证明CO2一定存在的现象是_____________。
参考答案:(1)??? A B E??? (2) C+2H2SO4
本题解析:(1)由图可以看出y导管插入到试剂瓶的底部,因此可用来干燥某些气体,也可用来除去气体中的某些杂质,或者用来收集密度大于空气的某些气体。若瓶内盛水,用以测量某难溶于水的气体的体积,则进气口应是x导管。同样瓶内贮存难溶于水的气体,加水时气体可被排出,进气口同样应是x导管。收集密度比空气小的气体,进气口应是x导管。故正确的答案是A B E。
(2)浓硫酸具有强氧化性,在加热的条件下可氧化单质碳,方程式为C+2H2SO4 CO2↑+2SO2↑+2H2O。产物有三种水蒸气、CO2和SO2,验证水蒸气用无水硫酸铜,CO2用饱和石灰水,SO2用品红溶液。由于后两者都需要通过溶液,因此首先验证水蒸气。因为SO2也可以使石灰水变混浊,因此在检验CO2之前,需要先检验SO2,并且还要完全除去SO2,以避免干扰CO2的检验。 CO2↑+2SO2↑+2H2O。产物有三种水蒸气、CO2和SO2,验证水蒸气用无水硫酸铜,CO2用饱和石灰水,SO2用品红溶液。由于后两者都需要通过溶液,因此首先验证水蒸气。因为SO2也可以使石灰水变混浊,因此在检验CO2之前,需要先检验SO2,并且还要完全除去SO2,以避免干扰CO2的检验。
本题难度:一般
|