微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室由氯化铵和熟石灰加热制取氨气的化学方程式:???????????????????????。检验氨气已装满的方法是:用_____________试纸靠近集气瓶口,现象为_________________。
(2)用图装置进行喷泉实验, 若加入酚酞,得到红色喷泉,若要得到蓝色喷泉呢,应加入酸碱指示剂?????????。

(3)完成氨催化氧化生成为NO的反应方程式,4NH3+???O2="==4NO" + 6?????,产物NO能在通常状况下被空气氧化为NO2,请完成下列反应生成硝酸的化学方程式:
4NO+?O2+2H2O="==" 4HNO3
??NO2+??????O2 +?H2O="==" 4HNO3
(4)1.28 gCu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为??????mol.
参考答案:(1)2NH4Cl + Ca(OH)2 本题解析:
本题解析:
试题分析:(1)实验室由氯化铵和熟石灰加热制取氨气的化学方程式是2NH4Cl + Ca(OH)2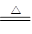 ?CaCl2 + 2NH3↑ + 2H2O。氨气是一种碱性气体,溶于水显碱性,所以可用用湿润的红色石蕊试纸靠近集气瓶口,而现象则是试纸变为蓝色。
?CaCl2 + 2NH3↑ + 2H2O。氨气是一种碱性气体,溶于水显碱性,所以可用用湿润的红色石蕊试纸靠近集气瓶口,而现象则是试纸变为蓝色。
(2)碱液能使紫色的石蕊试纸变为蓝色,所以若要得到蓝色喷泉呢,应加入酸碱指示剂石蕊试液。
(3)根据原子守恒可知,另外一种生成物应该是水。在反应中氮元素的化合价由-3价升高到+2价,失去5个电子,而氧元素的化合价从0价降低到-2价,得到2个电子,所以根据电子的得失守恒可知,配平后的方程式是4NH3+5O2="==4NO" + 6H2O;同样分析可知,另外两个反应的化学方程式分别是4NO+3O2+2H2O=4HNO3、4NO2+O2 +2H2O=4HNO3。
(4)浓硝酸的还原产物是NO2,和氧气混合溶于水后又生成硝酸,所以在反应中铜失去的电子相当于被氧气得到。所以根据电子的得失守恒可知,需要氧气的物质的量是 。
。
点评:该题是中等难度的试题,试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练。有利于培养学生的逻辑推理能力和创新思维能力。氧化还原反应的有关配平和计算的关键是准确判断出有关元素的化合价变化情况,然后根据电子的得失守恒即可得出正确的结论。
本题难度:一般
2、实验题 (2分)下列实验操作或对实验事实的描述中正确的说法有???????????????。
①如果苯酚浓溶液沾到皮肤上,应立即用酒精洗涤
②除去甲烷中混有的少量乙烯,可以让混合物通过盛有酸性KMnO4溶液的洗气装置
③实验室制硝基苯:向浓硝酸、浓硫酸的混合酸中滴入苯,在50~60℃的水浴中加热
④实验室制取乙烯时,将无水乙醇和10mol·L-1 H2SO4混合加热到1700C,可制得乙烯
⑤只用溴水就可将苯、四氯化碳、乙醇、己烯四种液体区别开来
⑥检验卤代烃中的卤离子,是将试样放入试管,然后加入NaOH煮沸,随即加入硝酸银即可。
参考答案:(2分)①③⑤
本题解析:②错,除去甲烷中混有的少量乙烯,可以让混合物通过盛有溴水溶液的洗气装置
④错,实验室制取乙烯时,将无水乙醇和18.4mol·L-1 H2SO4混合加热到1700C,可制得乙烯
⑥错,检验卤代烃中的卤离子,是将试样放入试管,然后加入NaOH煮沸,再加入过量的稀硝酸西化,随即加入硝酸银即可。
本题难度:一般
3、实验题 (14分)苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
?
| 苯甲酸
| 甲醇
| 苯甲酸甲酯
|
熔点/℃
| 122.4
| -97
| -12.3
|
沸点/℃
| 249
| 64.3
| 199.6
|
密度/g.cm-3
| 1.2659
| 0.792
| 1.0888
|
水溶性
| 微溶
| 互溶
| 不溶
实验一:制取苯甲酸甲酯
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。
(1)苯甲酸与甲醇反应的化学方程式为_______________?????????????? _________。
(2)大试管Ⅰ中除了装有15g苯甲酸和一定量的甲醇和一定量浓硫酸外还需要加入??????????????????????????????
??????????????????????????????????????????????????????????????????????。
(3)中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有??????????????????????
??????????????????????????????????? __________________?? ________??????。
实验二:提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(4)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是??????????????????。
(5)用图C装置进行蒸馏提纯时,当温度计显示______时,可用锥形瓶收集苯甲酸甲酯。
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(6)比较有、无浓硫酸存在条件下酯化反应进行的快慢,在其他实验条件相同时需要测量的实验数据是???????????。
参考答案:(1)???????????????????????????
本题解析:(1)苯甲酸与甲醇反应是酯化反应方程式为
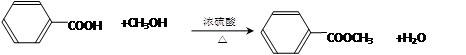
(2)该反应是液体加热的反应所以在加热之前必须向溶液中加入碎瓷片,防止暴沸。
(3)酯化反应是一个可逆反应,要增大酯的浓度可以采取把酯蒸出,提高醇的用量的方法都可以使平衡向正向移动。
(4)制取的酯中经常含有乙醇和苯甲酸,乙醇易溶于水可除去,苯甲酸与碳酸钠发生反应可以除去,所以碳酸钠的作用是除去苯甲酸甲酯中得苯甲酸。
(5)苯甲酸甲酯的沸点是199.6℃,所以当温度为199.6℃开始收集
(6)要比较快慢必须要有时间参数,所以在其他实验条件相同时需要测量的实验数据是时间。
本题难度:一般
4、选择题 下列气体中,能用排水法收集的是( )
A.H2
B.HCl
C.NO2
D.Cl2
参考答案:A、H2不易溶于水、也不能与水反应,所以能用排水法,故A正确
本题解析:
本题难度:简单
5、选择题 为了净化和收集由盐酸和大理石制得的CO2气体,从下图中选择合适的的装置并连接。合理的是

A.a-a′→d-d′→e
B.b-b′→d-d′→g
C.c-c′→d-d′→g
D.d-d′→c-c′→f
参考答案:C
本题解析:由盐酸和大理石制得的CO2气体中会含有杂质H2O(g)和HCl,除去的试剂分别为浓硫酸和饱和碳酸氢钠溶液,应先让气体通过饱和NaHCO3溶液除去,再通过浓硫酸干燥。CO2的相对分子量为44,比空气(29)的大,因此收集CO2时应用瓶口向上排空气法。所以正确的答案应为C选项。
本题难度:一般
|