微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在密闭容器中,CO(g)与水蒸气发生如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g)
该反应在80℃时的平衡常数为1.0.如果反应开始时,一氧化碳和水蒸气的浓度都是1mol?L-1,计算一氧化碳在此条件下的平衡转化率.______.
参考答案:令平衡时CO的浓度变化量为xmol/L,则:
CO(
本题解析:
本题难度:一般
2、选择题 某温度下,H2 (g) + CO2 (g)  ?H2O(g) + CO(g) (ΔH>0)的平衡常数
?H2O(g) + CO(g) (ΔH>0)的平衡常数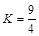 ,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:
,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:
起始浓度(mol/L)
| 甲
| 乙
| 丙
| 丁
|
c(H2)
| 0.01
| 0.02
| 0.02
| 0.005
|
c(CO2)
| 0.01
| 0.01
| 0.02
| 0.005
|
c(H2O)
| 0
| 0
| 0
| 0.005
|
c(CO)
| 0
| 0
| 0
| 0.005
下列判断有错的是
A.平衡时,乙中CO2的转化率>60%???????????
B.平衡时,四容器中甲的 值最小 值最小
C.起始时丁向正反应方向进行????????????????????????????
D.反应开始时,丙中反应速率最快
参考答案:B
本题解析:根据平衡常数可知,甲中平衡时生成CO和水的物质的量浓度都是x,则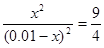 ,解得x=0.006,所以甲中CO2的转化率是60%,乙可以看作是在甲的基础上增加氢气的浓度,所以提高CO2的转化率,A正确。平衡常数只与温度有关系,所以四个容器中平衡常数是相同的,B不正确。选项C中 ,解得x=0.006,所以甲中CO2的转化率是60%,乙可以看作是在甲的基础上增加氢气的浓度,所以提高CO2的转化率,A正确。平衡常数只与温度有关系,所以四个容器中平衡常数是相同的,B不正确。选项C中 = =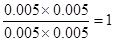 < < ,所以反应向正反应方向进行,C正确。丙中反应物的浓度增大,反应速率最快,D正确。答案选B。 ,所以反应向正反应方向进行,C正确。丙中反应物的浓度增大,反应速率最快,D正确。答案选B。
本题难度:一般
3、选择题 在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol/L。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是[???? ]
A.前2s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B.在2s时,体系内压强为反应前的1.1倍
C.平衡时,体系内含N2O4 0.25 mol
D.平衡时,若往容器内充入二氧化氮气体 ,则可提高N2O4的转化率
参考答案:B
本题解析:
本题难度:一般
4、选择题 在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应在一定压强下,达到平衡时测得NH3的物质的量为0.6mol。若在该容器中开始时充入2.0 molN2和6.0molH2,则平衡时NH3的物质的量为?
A.若为定容容器,n(NH3)=1.2mol
B.若为定压容器,n(NH3) >1.2mol
C.若为定容容器,n(NH3)>1.2mol
D.若为定压容器,n(NH3)<1.2mol
参考答案:C
本题解析:
试题分析:反应 91exam.orgN2(g)+3H2(g) NH3(g)的前后气体系数不同,所以若恒温恒容,反应要达到等效平衡,必须充入等量的N2和H2 ,所以充入2.0 molN2和6.0molH2 不能达到等效平衡,而是相当于加压,平衡右移,转化率升高生成更多NH3 ,故n(NH3)>1.2mol,;若保持恒温恒压,反应要达到等效平衡,则应该充入的N2和H2 应和原来的比例相同即n(N2):n(H2)= 1:3,所以充入2.0 molN2和6.0molH2满足等比例,可以达到等效平衡,故n(NH3)=1.2mol,所以综上所述应该选择C。 NH3(g)的前后气体系数不同,所以若恒温恒容,反应要达到等效平衡,必须充入等量的N2和H2 ,所以充入2.0 molN2和6.0molH2 不能达到等效平衡,而是相当于加压,平衡右移,转化率升高生成更多NH3 ,故n(NH3)>1.2mol,;若保持恒温恒压,反应要达到等效平衡,则应该充入的N2和H2 应和原来的比例相同即n(N2):n(H2)= 1:3,所以充入2.0 molN2和6.0molH2满足等比例,可以达到等效平衡,故n(NH3)=1.2mol,所以综上所述应该选择C。
本题难度:一般
5、选择题 1mol X气体跟a rnol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)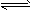 b Z(g)反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是 [???? ] b Z(g)反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是 [???? ]
A.a=1,b=1
B.a=2,b=1
C.a=2,b=2
D.a=3,b=2
参考答案:AD
本题解析:
本题难度:一般
|