微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
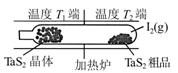
1、选择题 T℃时,在V L恒容密闭容器中加入足量的TaS2(s)和1 mol I2(g),发生反应TaS2(s)+2I2(g) TaI4(g)+S2(g) △H>0。t min时生成0.1 mol TaI4。下列说法正确的是
TaI4(g)+S2(g) △H>0。t min时生成0.1 mol TaI4。下列说法正确的是
A.0~t min内,v(I2)=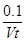 mol·L-1·min-1
mol·L-1·min-1
B.若T℃时反应的平衡常数K=1,则平衡时I2的转化率为2/3
C.如图制备TaS2晶体过程中循环使用的物质是S2(g)
D.图中T1端得到纯净TaS2晶体,则温度T1<T2
参考答案:BD
本题解析:
试题分析:A、0~t min内,v(I2)=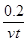 mol·L-1·min-1,错误;
mol·L-1·min-1,错误;
B、?????? TaS2(s)+2I2(g) TaI4(g)+S2(g)
TaI4(g)+S2(g)
始量??????????? 1
转化量????????? 2x?????? x?????? x
平衡量???????? 1-2x????? x???????x
k=x×x/(1-2x)2=1? x=1/3??平衡时I2的转化率为2/3÷1=2/3,正确;
C、制备TaS2晶体过程中循环使用的物质是I2(g),错误;D、反应吸热,温度高平衡正向移动生成TaI4,温度低得到TaS2晶体,故T1<T2,正确。
本题难度:一般
2、选择题 利用原料气在合成塔中合成NH3,为加快正反应速率,且提高N2的转化率所采取的措施是?(???)。
A.加压
B.移走氨气
C.使用催化剂
D.充入N2
参考答案:A
本题解析:
试题分析:氨气的生成是体积减小的可逆反应,所以为加快正反应速率,且提高N2的转化率,可以通过加压的方法实现,A正确。B中反应速率降低,C中转化率不变,D中氮气的转化率降低,答案选A。
点评:该题的关键是在明确可逆反应特点的基础上,灵活运用外界条件对反应速率和平衡状态的影响,有助于培养学生的逻辑推理能力和灵活应变能力。
本题难度:简单
3、填空题 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)已知:H-H键能为436kJ?mol-1,N≡N键能为946kJ?mol-1,N-H键能为391kJ?mol-1.写出合成氨反应的热化学方程式:______
(2)恒温下,往一个4L的密闭容器中充人5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30
c(NH3)/mol?L-1
0.08
0.14
0.18
0.20
0.20
0.20
①5min内,消耗H2的平均反应速率为______
②N2的平衡转化率______
③此条件下该反应的化学平衡常数K=______.反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,化学平衡将向______方向移动(填“正反应”或“逆反应”);化学平衡常数值______(填变大、变小、不变);
④若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度______0.4mol?L-1(填大于、小于与等于)
参考答案:(1)反应N2(g)+3H2(g)?2NH3(g)的反应热△
本题解析:
本题难度:简单
4、选择题 工业上制备纯硅反应的热化学方程式如下: SiCl4(g)+2H2(g)===Si(s)+4HCl(g);ΔH=+Q kJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是[???? ]
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025 Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好反应
参考答案:D
本题解析:
本题难度:简单
5、选择题 从下列事实,不能用勒夏特列原理解释的是?(? )
A.在溴水中存在如下平衡:Br2+H2O  HBr+HBrO当加入NaOH溶液后颜色变浅 HBr+HBrO当加入NaOH溶液后颜色变浅
B.对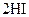  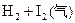 平衡体系增加压强使颜色变深 平衡体系增加压强使颜色变深
C.反应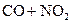  CO2+NO△H<0升高温度使平衡向逆方向移动 CO2+NO△H<0升高温度使平衡向逆方向移动
D.合成氨反应:  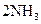 ,△H<0 为使氨的产率提高,理论上应采取低温高压的措施 ,△H<0 为使氨的产率提高,理论上应采取低温高压的措施
参考答案:B
本题解析:略
本题难度:简单
|