微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下,可逆反应A(气)+3B(气)  2C(气)达到平衡的标志是(???? )?
2C(气)达到平衡的标志是(???? )?
A.A、B、C的分子数比为132???????
B.A、B、C的浓度相等
C.C生成的速率与C分解的速率相等???
D.单位时间生成n mol A,同时生成3n mol B
参考答案:C
本题解析:
试题分析:对于一个可逆反应,达到化学平衡的特征为1.正反应速率等于逆反应速率。2.各物质的浓度保持不变。A选项,各物质在达到化学平衡时不一定是按化学计量数的比例存在。所以A选项是错误的。B选项是各物质的浓度保持不变,不是相等,所以B 选项是错误的。D应该为单位时间生成n mol A,同时消耗3n mol B
本题难度:一般
2、选择题 可逆反应3H2+N2 2NH3达到平衡的标志是(???? )。
2NH3达到平衡的标志是(???? )。
①消耗3 mol H2的同时生成2 mol NH3
②1个N≡N键断裂的同时,有3个H-H键形成
③H2、N2与NH3的物质的量之比为3∶1∶2
④1个N≡N键断裂的同时,有6个N-H键断裂
⑤1个N≡N键断裂的同时,有6个N-H键形成
A.①②⑤
B.②④
C.①②③④
D.全部
参考答案:B
本题解析:①消耗3 mol H2的同时消耗2 mol NH3,②1个N≡N键断裂的同时,有3个H-H键形成④1个N≡N键断裂的同时,有6个N-H键断裂,平衡状态的标志。
本题难度:一般
3、填空题 (10分)在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300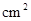 ,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
2A(g)+B(g) 2C(g);?H=-180 kJ·
2C(g);?H=-180 kJ·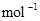
(1)若平均每分钟生成0.5 mol的C,则此反应速率可表示为v(C)=____________;若容器表面向外散热速率平均为400 J·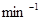 ·
·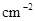 ,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
(2)反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是_____??___。
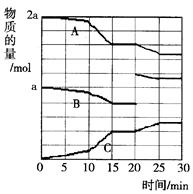
A.10~15 min可能是加入了正催化剂
B.10~15 min可能是降低了温度
C.20 min时可能是缩小了容器体积
D.20 min时可能是增加了B的量
参考答案:(10分)(1)0.25 mol· 本题解析:(1) v=
本题解析:(1) v=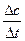 =
=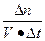 =0.25 mol·
=0.25 mol·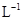 ·
·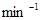
(2)每分钟体系向外散热为:0.400 KJ·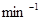 ·
·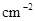 ×300=120kJ
×300=120kJ
而反应本身放热为:180 kJ·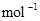 ×2/0.5=45kJ
×2/0.5=45kJ
故为了维持恒温t℃,平均每分钟需用加热器提供120-45=75kJ的热量
(3) 10~15 min时反应速率加快,加入正催化剂符合题意,但降低温度将使反应速率降低;20 min时只有B的量瞬间增大,故可能是增加了B的量,而缩小了容器体积,B的量不会瞬间增大。
本题难度:一般
4、实验题 (12分) 在实验室,可以用如图所示的装置制取乙酸乙酯。回答下列问题:
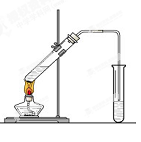
(1)右侧试管中的盛放的是????????????????,导气管的下端不能插入液面以下,其目的是??????????????。
(2)写出实验室制取乙酸乙酯的化学反应方程式????????????????????????,该反应的类型是??????????。
(3)该反应是典型的可逆反应,若不把生成的乙酸乙酯及时蒸馏出来,反应一段时间后,就会达到化学平衡状态。下列能说明该反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸;
④正反应的速率与逆反应的速率相等;
⑤混合物中各物质的浓度不再变化。
参考答案:(共12分)(1)饱和碳酸钠溶液?防止倒吸?(4分)
本题解析:(1)由于乙酸和乙醇都是易挥发的,所以为了除去乙酸乙酯中的乙酸和乙醇,需要加入饱和碳酸钠溶液。由于乙酸和乙醇都是和水互溶的,所以为了防止倒吸,导管口不能插入液面以下。
(2)酯化反应也是取代反应,方程式为
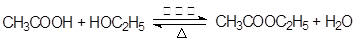 。
。
(3)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以④⑤正确。①③中反应速率的方向是相同的,所以不能说明。②反应速率的方向相反,且满足速率之比是相应的化学计量数之比,可以说明,所以答案选②④⑤,
本题难度:一般
5、选择题 下列事实可用勒夏特列原理解释的是
A.使用催化剂有利于加快合成氨反应的反应速率
B.硫酸工业中,将黄铁矿粉碎后加入沸腾炉中
C.500℃左右比在室温时更有利于提高合成氨的转化率
D.配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释
参考答案:D
本题解析:
试题分析:勒夏特列原理也就是平衡移动原理,能用此原理解释的事实具备如下特点:涉及可逆反应的平衡移动且符合平衡移动原理;A、使用催化剂有利于加快合成氨反应的反应速率,但平衡不移动,不能用勒夏特列原理解释,错误;B、硫酸工业中,将黄铁矿粉碎后加入沸腾炉中,增大了反应物的接触面积,反应速率加快,但平衡不移动,不能用勒夏特列原理解释,错误;C、合成氨的反应为放热反应,升温,平衡逆向移动,氨的转化率降低,不能用勒夏特列原理解释,错误;D、配制氯化铁溶液时,将氯化铁加入盐酸中,抑制铁离子的水解,可用勒夏特列原理解释,正确。
本题难度:一般