微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下实验目的能达到的是(? )
A.测Zn的相对原子质量可以通过测Zn的质量以及这些Zn和过量的稀硫酸反应时放出H2的体积
B.测Na2CO3、NaHCO3混合物中Na2CO3的质量分数可以通过测样品的质量及样品和过量Ba(OH)2溶液反应的沉淀的质量
C.测中和热时,可以用稀氨水代替NaOH溶液
D.将淀粉溶液滴入某混合液中,检验是否含有碘化钾
参考答案:B
本题解析:A项:气体的体积与温度、压强有关,必须记录或换算为标准状况;C项:NH3·H2O为弱电解质,电离时会吸热。B项由m(混合物)和m(沉淀)两个条件列方程组求解;D项淀粉只能检验碘分子存在,不能检验碘离子存在,D错误。
本题难度:一般
2、实验题 (16分)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:?0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有??????????中的一种或两种。
【实验探究】
?
| 实验操作
| 预期现象
| 结?论
|
验证猜想Ⅰ
| 步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液
| ????????
| ????????
|
步骤②:????????????
| ????????
| 含有Fe3+
|
验证猜想Ⅱ
| 将所得气体通入如下装置
| ????????
| 含有两种气体

【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:??????????????????
????????????????????????????????????????????????????????????????????。
参考答案:(16分)SO2、H2??(2分)
猜想Ⅰ
步骤
本题解析:略
本题难度:简单
3、选择题 下列操作不合适的是
A.银镜反应采用水浴加热
B.用通过溴水的方法除去甲烷气体中含有的CH2=CH2杂质
C.在乙醛还原新制的CU(OH)2悬浊液的实验中,制CU(OH)2悬浊液时应加入过量的NaOH溶液,可直接加热
D.配制银氨溶液时,将AgNO3溶液滴入氨水中
参考答案:D
本题解析:A 正确,醛类物质发生银镜反应需要水浴加热。
B 正确,通过溴水可以除去甲烷中的乙烯气体。
C 正确,新制的CU(OH)2悬浊液应该是碱性的,所以加入过量的NaOH溶液。
D 错误,配制银氨溶液时,将氨水滴入AgNO3溶液中。
本题难度:一般
4、填空题 钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料.制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位.含有Fe2O3的钛铁矿(FeTiO3)制取TiO2的流程如下:
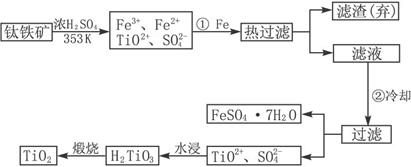
(1)Ti的原子序数为22,Ti位于元素周期表中第______周期,第______族.
(2)步骤①加Fe的目的是______;步骤②冷却的目的是______.
(3)上述制备TiO2的过程中,可以利用的副产物是______;考虑成本和废物综合利用因素,废液中应加入______处理.
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:已知:
①C(s)+O2(g)=CO2(g);△H=-393.5kJ?mol-1
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ?mol-1则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=______.反应TiCl4+2Mg=2MgCl+Ti?在Ar气氛中进行的理由是______.
参考答案:(1)Ti位于元素周期表中第四周期ⅣB族,故答案为:四;ⅣB
本题解析:
本题难度:一般
5、实验题 工业上将纯净干燥的氯气通入到0.375 mol/L NaOH溶液中得到漂白水。某同学想在实验室探究Cl2的性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸反应可以制取Cl2。
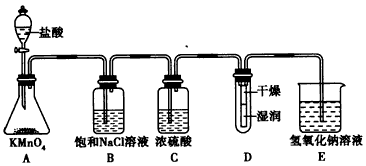
(1)配制物质的量浓度为0.375 mol/L NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和___________。
(2)浓硫酸的作用是______________________。
(3)装置E中发生反应的离子方程式为______________________________。
(4)装置B中的饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述用饱和NaCl溶液除去Cl2中的HCl气体的原理(用离子方程式表示和文字说明)_______________。
(5)实验时装置D中湿润的部分红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因;如需改进,请简述设计方案(若认为合理,则此问可不作答)___________________。
(6)氯元素含量为10%的漂白水溶液355 g,其中含NaClO的物质的量为___________mol。
参考答案:(1)容量瓶
(2)干燥氯气
(3)Cl2+
本题解析:
本题难度:一般
|