微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于置换反应
D.生成1molN2有12mol电子转移
参考答案:D
本题解析:
试题分析:A、如果管道漏气,发生反应3Cl2+2NH3=N2+6HCl,反应生成HCl,HCl与NH3反应生成NH4Cl,现象为有白烟生成,正确;B、在3Cl2+2NH3=N2+6HCl反应中,Cl元素的化合价由0价降低为-1价,氯气表现出氧化性,正确;C、置换反应是单质与化合物反应生成另外的单质和化合物的化学反应,3Cl2 + 2NH3 = N2 + 6HCl符合,正确;D、在3Cl2+2NH3=N2+6HCl反应中,N元素的化合价由-3价升高到0价,则生成1molN2有6mol电子转移,错误。
考点:考查氯气的化学性质,氧化还原反应。
本题难度:一般
2、选择题 贵州凤岗的“富锌富硒”茶已享誉全国,因富含硒元素,有延年益寿、抗衰老等作用。但研究表明单质硒可能成为环境污染物,通过与浓盐酸、浓H2SO4反应可回收Se。在回收过程中涉及到如下两个化学反应:①SeO2+4KI+4HCl=Se+2I2+4KCl+2H2O;②Se+2H2SO4(浓)=2SO2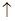 + SeO2+2H2O。下列叙述正确的是( )
+ SeO2+2H2O。下列叙述正确的是( )
A.反应①中Se是氧化产物,I2是还原产物
B.反应②中浓H2SO4是氧化剂,SeO2是还原产物
C.反应①中每有1.0mol I2生成,转移电子数目为4 NA
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2
参考答案:D
本题解析:
试题分析:A.在反应①中Se是还原产物,I2是氧化产物,错误;B.在反应②中浓H2SO4是氧化剂,SeO2是氧化产物,错误;C.在反应①中每有1.0mol I2生成,转移电子数目为2 NA,错误;D.在反应中氧化剂的氧化性强于氧化产物的氧化性,所以把两个反应中物质的氧化性强弱结合起来,则SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2,正确。
考点:考查氧化还原反应的概念、电子转移、氧化性强弱的比较的知识。
本题难度:一般
3、选择题 在下列变化中,需要加入合适的氧化剂才能实现的是
A.Na2O2→O2
B.Cl2→Cl-
C.Fe3+→Fe2+
D.Cl-→Cl2
参考答案:D
本题解析:
试题分析:A.在Na2O2与水或CO2反应产生O2中,Na2O2既作氧化剂,也作还原剂,错误;B.在Cl2与水或NaOH反应产生Cl-中,Na2O2既作氧化剂,也作还原剂,错误;C.在Fe3+→Fe2+的反应中Fe得到电子,作氧化剂,所以需要外加还原剂,错误;D.在Cl-→Cl2的反应中Cl失去电子,作还原剂,所以需要外加氧化剂,正确。
考点:考查物质在化学变化中的作用的知识。
本题难度:一般
4、选择题 设NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol氦气中有2NA个氦原子
B.18 g水中所含的电子数为10NA
C.0.3 mol·L-1Na2SO4溶液中含0.6NA个Na+
D.11.2L氮气中含NA个氮原子
参考答案:B
本题解析:
试题分析:氦气是氮原子分子,所以1 mol氦气中有NA个氦原子。一个水分子含有10个电子,18 g水是1mol,所以含电子数为10NA。0.3 mol·L-1Na2SO4溶液不知道体积,不能确定其物质的量。11.2L氮气中含NA个氮原子,不在标准状况下不能确定物质的量。答案选B。
考点:阿伏加德罗常数
点评:阿伏伽德罗常数是历年高考的“热点”问题。多年来全国高考化学试题出现的几率为100%。这双因为它既考查了学生对物质的量与粒子数、质量、气体体积和物质的量浓度之间的关系,又可以与物质结构、盐类水解、弱电解质的电离等其他的概念性知识点结合成综合性习题。
本题难度:困难
5、选择题 下列变化可以通过一步化学反应实现的是
A.NaHCO3→Na2O
B.NaNO3→NaCl
C.Na2CO3→NaOH
D.Fe(OH)3→NaOH
参考答案:C
本题解析:
本题难度:简单